某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是: 和 。
(2)试通过计算确定该结晶水合物的化学式为 。
(3)①加入Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为
。
②若加人75mL的Ba(OH)2溶液,则得到的沉淀质量为 g。
根据正放在桌面上的右图装置,回答下列问题: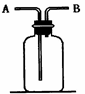
(1)现有H2、SO2、NH3、N2四种气体
①用排空气法收集某气体,则由A口进气可收集到的气体为。
②用排水法收集某气体,可在该容器中充满水,气体应由口进入。
(2)若用该装置除去H2中的水分,容器中可盛放的试剂为。
A、B、C、D四种元素均为短周期元素,其原子半径依次减小,它们的气态氢化物分子所含的电子数相同,C元素原子的最外层电子数是内层电子数的3倍。根据以上信息,按要求填空。
(1)A的最高价氧化物的电子式。
(2)D在周期表中的位置。
(3)在25℃、101KPa下,已知1g A的气态氢化物在足量氧气中燃烧后恢复到原状态,放出55.6KJ的热量,该反应的热化学方程式。
(1)写出碳酸钙与醋酸反应的离子方程式:。
(2)乙烯通入溴水中的化学方程式:。
目前市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
| 分装日期 |
|
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)KIO3+KI+H2SO4=K2SO4+I2+H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是。
②某学生设计回收四氯化碳的操作步骤为:
a将碘的四氯化碳溶液置于分液漏斗中;
b加入适量Na2SO3稀溶液;
c分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a准确称取wg食盐,加适量蒸馏水使其完全溶解;
b用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c以淀粉为指示剂,逐滴加入物质的量浓度为1.00×10-3mol·L-1的Na2S2O3溶液24.00mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg。
已知甲、乙、丙、丁、戊、己六种物质中含同一种元素,它们之间的转化关系如右图所示。其中,丁是一种红褐色絮状沉淀,戊是一种白色沉淀。请回答下列问题: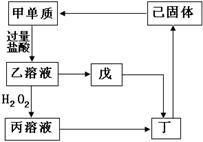
(1)甲→乙的化学方程式:。
(2)在乙溶液中加入H2O2溶液后,观察到的现象是:;如果在乙溶液中加入新制的氯水,该反应的离子方程式是:。
(3)由丙的饱和溶液可以制得丁为分散质的胶体,该胶体中丁粒子直径的大小范围是;实验室常用来区分溶液和胶体这两种分散系。