有8种物质:①甲烷、②苯、③聚乙烯、④聚异戊二烯、⑤2-丁炔、⑥环己烷、
⑦邻二甲苯、⑧环己烯,既能使酸性KMnO4溶液褪色,又能使溴水因反应褪色的是
| A.③④⑤⑧ | B.④⑤⑦⑧ | C.④⑤⑧ | D.③④⑤⑦⑧ |
用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是()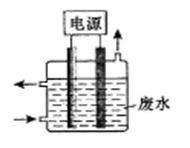
| A.可以用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:2CN-+12OH-—10e-=N2↑+2CO32-+6H2O |
| C.阴极的电极反应式为: Cl-+2OH- +2e-=ClO-+H2O |
| D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
下列有关实验操作、现象、解释和结论都正确的是()
| 操 作 |
现 象 |
解释、结论 |
|
| A |
过量的Fe粉中加入硝酸充分反应,滴入KSCN溶液 |
溶液呈红色 |
稀硝酸将Fe氧化为Fe3+ |
| B |
向饱和Na2CO3溶液中通入足量CO2 |
溶液变浑浊 |
析出了Na2CO3晶体 |
| C |
Al箔插入稀硝酸中 |
无现象 |
Al在硝酸中钝化,形成致密的氧化膜 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
某结晶水合物的化学式为R·nH2O,其相对分子质量为M, 25 ℃时,a g该晶体能够溶于b g水中形成V mL溶液。下列关系中不正确的是()
A.该溶液中溶质的质量分数为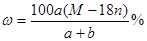 |
B.该溶液的物质的量浓度为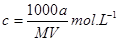 |
C.该溶液的密度为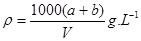 |
D.该溶液中溶质与溶剂的质量比为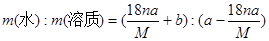 |
下列各组溶液,不用外加试剂,就能实现鉴别的是()
①CuSO4 K2SO4 KNO3 KOH
②Na2CO3 BaCl2 HCl Na2SO4
③NH4NO3 Na2SO4 Ba(OH)2 AlCl3
④NaAlO2 Na2SiO3 H2SO4 NaCl
| A.①③ | B.②④ | C.①③④ | D.②③④ |
下图是氧气氧化某浓度Fe 2+为Fe 3+过程的实验结果,下列有关说法正确的是()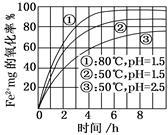
| A.pH=1.5时氧化率一定比pH=2.5时大 |
| B.其他条件相同时,80°C的氧化率比50°C大 |
| C.Fe 2+的氧化率仅与溶液的pH和温度有关 |
| D.该氧化过程的离子方程式为:Fe 2++O2+4H +==="Fe" 3++2H2O |