(10分)含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4这4种常见的含硫化合物。回答下列问题:
(1)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2 。写出该反应的化学方程式: 。
(2)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应: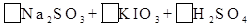 —
— 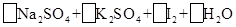
①配平上面的氧化还原反应方程式.将化学计量数填入方框中。
②其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘单质是 mol。
(3) 向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成。此沉淀是
| A.BaSO4 | B.FeS | C.BaSO3 | D.S |
(4)常温下,将铁棒置于浓硫酸中.无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化
利用盖斯定律回答下列问题:
已知热化学方程式
C(s、金刚石)+O2(g) —→ CO2(g); △H=-395.4kJ·mol—1
C(s、石墨)+O2(g) —→ CO2(g);△H = -393.5kJ·mol—1
由金刚石转化为石墨的热化学方程式为,由热化学反应方程式看来,更稳定的碳的同素异形体是。
有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷总数为36。Y元素原子最外层电子数占其核外电子总数的3/4,W元素原子最外层电子比同周期Z元素多5个电子,W和Y属于同一主族。
(1)写出元素符号:X______Y_________Z________W___________.
(2)Z、W两元素的最高价氧化物对应水化物反应的离子方程式是__________
①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题: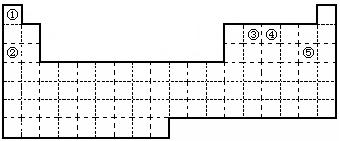
(1)①②③④⑤五种元素中,金属性最强的元素位置是(填周期和族),该元素的单质在空气中燃烧的化学方程式为。
(2)元素①和③可以形成众多的化合物,其中最简单的是(写化学式),
该化合物中,化学键的类型为(填“离子键”或“共价键”)。
(3)画出元素④的原子结构示意图,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)。
(4)写出元素⑤单质分子的电子式,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为。
若将苯倒入盛有溴水的试管中,振荡后静置,现象是,说明苯;若将碘晶体、食盐固体分别加入盛有苯的试管中,振荡后静置,现象是。
干电池是一种的装置。干电池外围的锌皮是电池的极,发生(“氧化” 或“还原” )反应;中间碳棒是电池的极,发生(“氧化” 或“还原” )反应。