8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)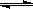 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
将10.7g氯化铵固体与足量熟石灰混合加热,使之充分反应。
(1)写出反应的化学方程式:。
(2)生成的氨气在标准状况下的体积是L。
(3)若将这些氨气溶于水配成500mL氨水,该氨水的物质的量浓度是mol·L-1。
(4)在400℃左右且有催化剂存在的情况下,用氨可以把一氧化氮还原成氮气,方程式为:4NH3+6NO=5N2+6H2O,此反应中氧化产物与还原产物的物质的量之比为。
在下图转化关系中,已知B、D都是淡黄色固体,请回答下列问题。
⑴写出下列物质的化学式:B,G。
⑵写出下列反应的化学方程式:
A→B:;E→F:;B→C:。
⑶将过量气体E通入到下列各组溶液后,离子仍能大量共存的是。
A.Ba2+、Ca2+、Cl-B.OH-、CO32-、Na+
C.Ca2+、ClO-、Cl- D.H+、Fe3+、NO3-
硝酸铵是一种常用的化肥,其工业生产流程如下图,请回答下列问题。
⑴写出反应容器B中发生反应的化学方程式:。
⑵吸收塔C中通入空气的目的是;C、D两个反应容器中发生的反应,属于氧化还原反应的是(填反应容器代号)。
⑶浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因:。
⑷金属铜与稀硝酸反应的离子方程式是,该反应中稀硝酸表现的性质是。
(1)25℃时,浓度为0.1 mol·L-1的6种溶液:①HCl, ②CH3OOH, ③Ba(OH)2,④Na 2CO3,⑤KCl,⑥NH4Cl溶液pH由小到大的顺序为__________________(填写编号)。
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=mol ·L-1(保留到小数点后一位)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈(填“酸性”,“中性”或“碱性”) ,请写出溶液中离子浓度间的一个等式:。
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,
则溶液中c(CH3COO-) + c(CH3COOH)=,m与n的大小关系是mn(填“ >”“=”或“<”)。
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7 ,则NH3·H2O的电离常数Ka=。
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。已知: >
> ,则该反应是热反应。
,则该反应是热反应。
(2)图中表示NO2的变化的曲线是。用O2表示从0~2 s内该反应的平均速率v=。
(3)能说明该反应已达到平衡状态的是。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.NO、O2、NO2的浓度之比为2:1:2
D.容器内密度保持不变
E.容器内气体的颜色不再变化
(4)缩小容器体积使压强增大,平衡向反应方向移动(填“正”或“逆”),K值(填“增大”、“减小”或“不变”)