已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。则绿色晶体配合物的化学式为 。
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度。回答下列问题: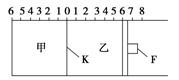
达到平衡后隔板K是否可能处于0刻度________(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(2)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为________mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度________处(填下列序号:①<6 ②>6 ③=6)。
(3)若一开始就将K、F固定,其他条件均不变,则平衡时,甲、乙中SO3的物质的量分数是甲________乙(填“>”、“<”或“=”);测得甲中SO2的转化率为w%,则乙中SO3的转化率等于________。
(4)平衡后将甲容器的混合气的1.0%通入足量Ba(NO3)2溶液,生成的BaSO4质量为________克。
在某2 L的密闭容器中加入0.1 mol碘单质和足量钨(W),在943 K时,发生反应W(s)+I2(g) WI2(g),当I2的转化率为20%时,达化学平衡状态。
WI2(g),当I2的转化率为20%时,达化学平衡状态。
(1)反应从开始至平衡状态过程中用时20 s,其平均反应速率v(WI2)为________。
(2)943 K时,该反应的平衡常数K=________。
(3)若起始时,加入的碘为0.2 mol(其他条件不变)达平衡时容器中气体的体积比
V(I2)∶V(WI2)=________。
(4)在上述(1)平衡状态下,同时增加I2(g)和WI2(g)各0.02 mol(其他条件不变),化学平衡向________(填“正反应”或“逆反应”)方向移动,判断的依据是______________________。
(共16分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)  xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物 C在反应混合物中的百分含量(C%)和反应时间(t)的关系。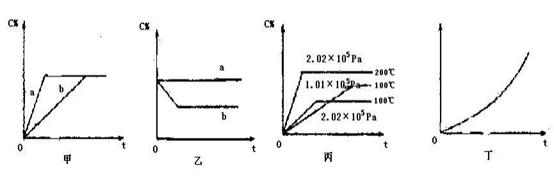
(1)若甲图中两条曲线分别代表有催化剂和无催化剂的情况,则曲线表示无催化剂时的情况,速率:ab(填:大于、小于或等于)
(2)若乙图表示反应达到平衡后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则曲线表示恒温恒容的情况,此时该恒温恒容中
C%(填:变大、变小或不变)
(3)根据丙图可以判断该可逆反应的正反应是热反应(填:放热、吸热),计量数x的值是;
(4)丁图表示在某固定容器的密闭容器中,上述可逆反应达到平衡后,某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是,[填:①C% ②A的转化率③B的转化率④压强⑤c(A)⑥c(B)];升温平衡移动的方向为。(填:左移或右移)
已知A(g)+B(g)  C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。
C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。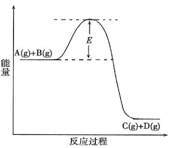
(1)该反应是_________反应(填“吸热”、“放热”)。当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),
(2)在反应体系中加入催化剂,反应速率增大,E的变化是_________,(填“增大”、“减小”或“不变”)理由是E的大小对该反应的反应热有无影响?。
已知
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1="+532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式