【物质结构与性质】
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
| |
X |
Y |
Z |
| I1 |
496 |
738 |
577 |
| I2 |
4562 |
1451 |
1817 |
| I3 |
6912 |
7733 |
2754 |
| |
9540 |
10540 |
11578 |
①三种元素电负性大小关系为_______________
②写出Y原子的电子排布式_____________ Y的第一电离能大于Z的第一电离能的原因_______________________
③X晶体采用下列_________(填字母)堆积方式。


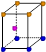
A B C D
(2)N2O的等电子体为:①分子______________,②阴离子______________;由此可知N2O的中心原子的杂化类型为_____________。根据价层电子对互斥模型确定NO2的分子构型为:_____________________________________。
(3)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,
请在图中标出水合铜离子中的配位键.
(9分)
(1)CO2的电子式为_________________;属于______________化合物(填“共价”或“离子”;
(2)H2O2的结构式为___________________,属于分子(填“极性”或“非极性”);
(3)SO42-中S原子的杂化方式为,该微粒的空间构型为;
(4)冰的密度比水的密度小的原因是;
(5)NH3极易溶于水的原因是:①_________________________、②______________________;
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢材年产量的四分之一。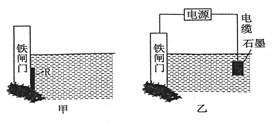
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________
(2)为了降低某铁闸门被腐蚀的速率,可以采用上述图甲所示的方案,其中焊接在铁闸门上的固定材料R可以采用____(填序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)上图乙所示的方案也可以降抵铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的_______极。
在某温度下,取一定质量的CuSO4溶液,用石墨做电极进行电解,当阳极产生标准状况下气体1.12 L时,CuSO4恰好被完全电解,得到密度为1.2 g/cm3的溶液200 mL。求:
(1)电解后,所得溶液的pH= 。
(2)电解前,所取CuSO4溶液的质量为 。
(3)若要使电解后所得溶液恢复至电解前的原始状态,需要加入 质量为 。
ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是____________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是___________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
化学电池是将化学能转变成电能的装置,包括一次电池、二次电池和燃料电池等几大类。燃料电池是目前正在探索的一种新型电池,已经使用的氢氧燃料电池的基本反应是:
X极:O2+2H2O+4e-=4OH-
Y极:2H2+4OH—=4H2O+4e-
请回答下列问题 :
(1)X是 极;Y极发生 反应(填“氧化”或“还原”)
(2)该电池总反应方程式为 。
(3)若反应后的得到5.4 g液态水,此时氢氧燃料电池转移的电子数为 。
(4)实验室用铅蓄电池作电源电解饱和食盐水,若制得Cl2 0.30 mol,电池内至少消耗H2SO4 mol。