已知天然气的主要成分CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应前者大,下面是有关天然气的几种叙述:①天然气与煤、柴油相比是较清洁的能源;②等质量的CH4与CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一。其中正确的是( )
| A.①②③ | B.只有① | C.①和② | D.只有③ |
在一密闭容器中,反应mA(g )  nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是 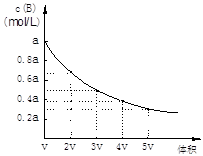
| A.物质B的质量分数增加 |
| B.平衡向逆反应方向移动 |
| C.物质A的转化率减小 |
| D.化学计量数:m>n |
在密闭容器中有可逆反应: 处于平衡状态(已知n+m>p),则下列说法正确的是
处于平衡状态(已知n+m>p),则下列说法正确的是
①升温,c(B)/c(C)的比值变小
②降温时体系内混合气体的平均相对分子质量变小
③加入B,A的转化率增大
④加入催化剂,气体总的物质的量不变
⑤加压使容器体积减小,A或B的浓度一定降低
⑥若A的反应速率为υA,则B的反应速率为υAn/m
A.①②③⑤ B.①②③④
C.①②⑤⑥ D.③④⑤⑥
在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是
A正反应为吸热反应 L是气体
B正反应为放热反应 L是固体或液体
C正反应为吸热反应 L是固体
D正反应为放热反应 L是气体
下图中a曲线表示一定条件下可逆反应X(g)+2Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。若使a曲线变为b曲线,可采用的措施是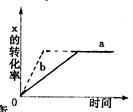
A 加入催化剂 B 增大Y的浓度
C 降低温度 D 增大体系压强
下列事实,不能用勒夏特列原理解释的是
A.氯水中有下列平衡:Cl2+H2O HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对2HI(g)  H2(g)+I2(g),平衡体系增大压强可使颜色变深 H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
C.反应CO+NO2  CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2+3H2 2NH3;DH<0) 2NH3;DH<0) |