(1) 二甲苯苯环上的一溴代物有六种同分异构体,用还原法制得三种二甲苯,它们的熔点分别如下表:
| 六种溴二甲苯的熔点 |
234℃ |
206℃ |
213.8℃ |
204℃ |
214.5℃ |
205 |
| 对应还原二甲苯的熔点 |
-13℃ |
-54℃ |
-27℃ |
-54℃ |
-27℃ |
-54℃ |
熔点为234℃分子的结构简式为____________
熔点为-54℃的分子的结构简式为___________。
(2)现有下列烃①丙烷(C3H8)、②丁烯(C4H8)、③乙烯(C2H4)、④己烷(C6H14)等物质的量的上述五种烃,耗氧量最小的为 ,等质量时,则耗氧量最大的为 。
(3) 0.2 mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
A 若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
B 若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是________________,结构简式是____________________。
C 比烃A少两个碳原子且能使溴水褪色的A的同系物有________种同分异构体
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,原因是。
② 哪一段时段的反应速率最小,原因是 。
③ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A 蒸馏水、B NaCl溶液、C NaNO3溶液、D CuSO4溶液、E Na2CO3溶液,你认为可行的是。
回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
(2)已知:波长为300nm的紫外光的光子所具有的
能量约为39 9 kJ/mol。
根据右表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:______________________________________________________________
_____________________________________________________________。
| 共价键 |
C-C |
C-N |
C-S |
| 键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中含有极性键的数目是___________ ;NH4+的空间构型是_______________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该 反应中有8mol N-H键断裂,则形成的π键有________mol。
(4)硼砂是含结晶水的四硼酸钠,其阴离子 (含B、O、H三种元素)的球棍模型如图所示:
(含B、O、H三种元素)的球棍模型如图所示:
①在 中,硼原子轨道的杂化类型有和________;配位键存在于原子之间(填原子的数字标号);m=(填数字)。
中,硼原子轨道的杂化类型有和________;配位键存在于原子之间(填原子的数字标号);m=(填数字)。
②硼砂晶体由 、
、 和
和 构成,它们之间存在的作用力有(填序号)。
构成,它们之间存在的作用力有(填序号)。
A.共价键 B.离子键 C. 氢键 D.范德华力 E. 金属键
请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光 B.焰色反应 C.原子光谱 D.燃烧放热 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有___________(填元素符号)
②在a:苯 b:CH3OH c:HCHO d:CS2 e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色。据此判断,[Mn(H2O) 6]]2+ _____________(填“无”或“有”)颜色
(4) 请写出HClO的电子式:_______________________;在下图配合物离子[Cu(NH3)4]2+.中的画出配位键:
(5) A、B均为短周期金属元素。依据下表数据和已学知识,
| 电离能/KJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
判断金属B的价电子电子排布式______,写出金属B与二氧化碳反应的化学方程式: _______________________________________________。
A、B、C、D、E、F为原子序数依次增大的短周期元素,B、C相邻且同周期,A、D同主族。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素。F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素
请回答下列问题:
(1)写出G基态原子的外围电子排布式。
(2)B和C比较,第一电离能较大的元素是(填元素符号),其原因为。
(3)甲、乙两分子中含有非极性共价键的是(填分子式)。
(4)已知化合物丁熔点190℃,沸点183℃,结构如图所示。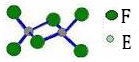
①丙和丁比较,熔点较低的化合物是(填化学式),其原因为。
②则丁晶体中含有的作用力有(填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(5)G3+与元素A、C、F构成配合物戊,在含有0.001mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到287mg白色沉淀。已知该配合物的配位数为6,则戊的化学式为。
(6)三聚氰胺(结构如图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化形式是。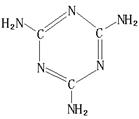
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。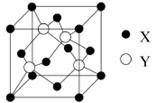
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为。
②该化合物的化学式为。
(2)在Y的氢化物分子中,Y原子轨道的杂化类型是。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为。
②写出一种与YZ42-互为等电子体的分子的化学式:。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为。