(7分) 科学家一直致力于“人工固氮”的方法研究。
⑴目前合成氨的技术原理为:
该反应的能量变化如图所示。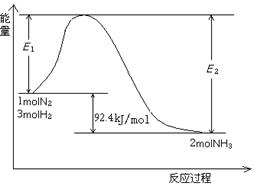
①在反应体系中加入催化剂,反应速率增大,E2的变化是: 。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
③欲提高②容器中H2的转化率,下列措施可行的是 。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
⑵1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为 。
⑶根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应: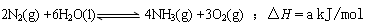
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①合成反应的a_ 0。(填“大于”、“小于”或“等于”)
②已知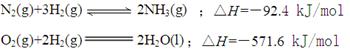
则
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)  Fe(s)+CO2(g) ΔH >0
Fe(s)+CO2(g) ΔH >0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向_______进行(填“左”或“右”),判断依据是
。
(2)一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)。
已知:2CO(g) + O2(g)=2CO2(g)ΔH =–566 kJ·mol―1
2H2O(g) =2H2(g) + O2(g)ΔH =+484 kJ·mol―1
CH3OH(g) + 1/2O2(g)=CO2(g) + 2H2(g)ΔH =–192.9 kJ·mol―1
请写出CO与H2在一定条件下反应生成CH3OH(g)的热化学方程式
。
(3)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mo
CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1,现向体积为1 L的密闭 容器中,充入1mol CO2和3mo l H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
l H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。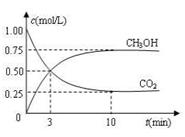
①从反应开始到平衡,氢气的平均反应速率v(H2)=________;
②反应达到平衡后,下列措施能使 增大的是______(填符号)。
增大的是______(填符号)。
| A.升高温度 | B.再充入H2 | C.再充入CO2 |
| D.将H2O(g)从体系中分离 E.充入He(g) |
室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀; 假设三:;
假设三:;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10 KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,②,③干燥。
步骤三:利用下图所示装置,进行定量分析:
① A装置中玻璃仪器的名称是。
② 仪器组装好后首先要进行的实验操作是。
③ 实验结束时通入过量的空气的作用是 。
④ 数据记录:
| B装置的质量(g) |
C装置的质量(g) |
D装置的质量(g) |
|
| 实验前 |
15.4 |
262.1 |
223.8 |
| 试验后 |
6.1 |
264.8 |
230.4 |
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式。
A、B、C、D、E、F六种物质,一定条件下有如下图所示的转化关系(所有的反应物和生成物均已给出):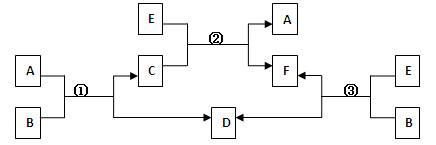
(1)若①、②、③均为水溶液中的置换反应,且A、D、E是常见的卤素单质,B、C、F为化合物。则A、D、E的氧化性由强到弱的顺序为(用字母表示),其中A的化学式为(用元素符号表示)。
(2)若B是一种淡黄色固体,绿色植物的呼吸作用和光合作用可实现自然界中D和E的循环,则F的化学式为;反应①的离子方程式是。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是;反应③是某些氮肥厂获得合成氨原料D的一个重要反应,假设反应后的气体中只有F和D,从综合经济效益的角度考虑,简述如何从反应后的混合物中分离出D。。
已知某粒子的结构示意图为
试回答:
(1)当x-y=10时,该粒子为(填“原子”、“阳离子”或“阴离子”)
(2)写出y =3与y =7的元素最高价氧化物对应水化物间发生反应的离子方程式:
。
(3)当y=8时,粒子可能为。
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。请推断后回答下列问题:
(1)写出:W的原子结构示意图,R离子的电子式,
Y在周期表中的位置。
(2)X、Y、Z三种元素形成的化合物属于化合物(填“离子”或“共价”),其电子式为 。
。
(3)Z在Y单质中燃烧的产物电子式为,其中含有的化学键类型为。
(4)Y、Z、W、R形成的简单离子半径由大到小顺序为。
(5)W单质与Z的高价氧化物对应的水化物反应的离子方程式为。