(14分)金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有______个原子共平面。
(2)金刚烷的分子式为__________。
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应②的反应试剂和反应条件是___________,反应③的反应类型是____________,反应④的化学方程式为 。
(4)已知烯烃能发生如下反应: 。
。
请写出下列反应产物的结构简式: ____________________________。
____________________________。
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经酸性高锰酸钾溶液加热氧化可以得到对苯二甲酸( )[提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经酸性高锰酸钾溶液氧化得羧基(—COOH)],写出A所有可能的结构简式(不考虑立体异构):_____________。
)[提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经酸性高锰酸钾溶液氧化得羧基(—COOH)],写出A所有可能的结构简式(不考虑立体异构):_____________。
工业上利用反应:CO(g)+H2O(g) 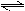 CO2(g)+H2(g);△H="Q" kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。
CO2(g)+H2(g);△H="Q" kJ·mol-1,制备H2 .已知该反应的平衡常数K与温度的关系如图所示。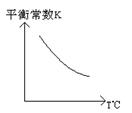
若在一容积固定的密 闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
闭容器中,于850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
| t/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c4 |
| 4 |
c1 |
c2 |
c3 |
c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是_______.
A.单 位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q______0(填“>”、“=”或“<”).
(3)若在850℃时向反应容器中充入H2O(g),K值___ __(填“增大”、“减小”或“不变”).
__(填“增大”、“减小”或“不变”).
(4)达平衡时CO2的反应速率______,CO(g)的转化率为_______.
在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H 2 及固体催化剂,使之反应.已知:N2(g)+3H2(g)
2 及固体催化剂,使之反应.已知:N2(g)+3H2(g) 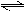 2NH3(g);△H="-92.2" kJ·mol-1.平衡时,容器内气体压强为起始时的80%.
2NH3(g);△H="-92.2" kJ·mol-1.平衡时,容器内气体压强为起始时的80%.
(1)反应达到平衡时,放出的热量_______.
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)欲使H2的转化率提高为原来的两倍,则在其他条件不变的情况下,应将N2的初始量由2mol提高至__________mol.
(3)保持同一温度,在相同的容器中,若起始时加入2molNH3、1molH2 及固体催化剂,反应达到平衡时NH3的体积分数_________.
A.等于0.25 B.大于0.25 C.小于0.25
(4)右图是T1℃时容器中NH3的物质的量随时间的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线.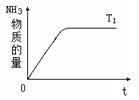
根据要求写出下列反应的热化学方程式
(1)一定量氢气与氯气反应生成氯化氢气体,当生成1mol氢氯键时放出91.5kJ的热量________________________________________________________.
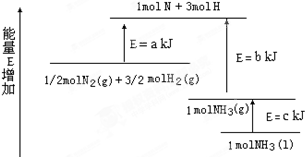
(2)某化学反应的能量变化如图所示,该反应的热化学方程式是(反应热用abc表示)
_____________________________________________.
(3)某反应的平衡常数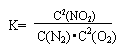 如果有1molN2完全反应,要吸收热量68kJ.写出该反应的热化学方程式______________________________________________.
如果有1molN2完全反应,要吸收热量68kJ.写出该反应的热化学方程式______________________________________________.
(4)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol
C(石墨,s)+O2(g)=CO2(g) ;ΔH2="-393.5" kJ/mol
H2(g)+1/2O2(g)=H2O(l) ;△H3="-285.8" kJ/moL
则由石墨与氢气反应生成甲烷的热化学反应方程式为__________________________________________.
工业上氨气的催化氧化是制取硝酸的基础.在一定温度下将4mol NH3和4mol O2两种气体混合于2L密闭容器中,发生如下反应:4NH3(g)+5O2(g)  4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
△H<0,2分钟末生成了1.2molH2O,则:
(1)用H2O表示的反应速率为________mol/(L•min).
(2)O2在2分钟末的浓度为_______mol /L.
(3)判断该反应达到平衡状态的标志是______(填字母).
a.NH3和NO浓度相等b.NO百分含量保持不变
c.容器中气体的压强不变d.NO的生成速率与NH3的消耗速率相等
e.容器中混合气体的密度保持不变f.O2的质量不再改变
(4)欲提高NH3的转化率,下列措施可行的是(填字母).
a.向装置中再充入O2b.改变催化剂
c.增大压强d.提高温度
发射卫星时可用肼(N2H4)为燃料,已知某温度下1.6g气态肼在空气中完全燃烧生成氮气和水蒸气,放出热量28 kJ,则肼燃烧的热化学方程式为______________________
______________________________________;又知氮气在相同条件下燃烧的热化学方程式为:N2(g)+2O2(g)=2NO2(g) ;△H=+68kJ·mol-1.则该条件下1mol气态肼和二氧化氮完全反应生成氮气和水蒸气时放出的热量为______kJ.