含苯酚的工业废水的处理流程如图所示。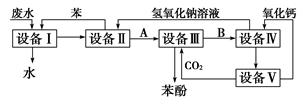
(1)①流程图设备Ⅰ中进行的是______操作(填写操作名称)。
②图中,能循环使用的物质是:C6H6、CO2______、______。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是_______________________________________________________。
(3)从废水中回收苯酚的方法是:①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③通入某物质又析出苯酚。试写出②、③两步的反应方程式:
_________________________________________________________________________________________。
一定条件下,有如下反应:
2CO (g) + O2(g)=2CO2(g)ΔH1=" -" 566.0kJ·mol-1
3Fe(s) +2O2(g)=Fe3O4 (s)ΔH2=-1118.3kJ·mol-1
Fe3O4(s)+4CO(g) 3Fe(s) +4CO2 (g) ΔH3
3Fe(s) +4CO2 (g) ΔH3
(1)试计算,ΔH3 =
(2)已知1100℃时,反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2 (g) ΔH3的化学平衡常数为4.8×10-3。若在1100℃时,测得高炉中c(CO2)=0.020mol·L-1,c(CO)=0.10mol·L-1,此时该反应(填“是”或“否”)处于平衡状态,理由是,此时υ正υ逆(填“>”、“<”或“=”)。
3Fe(s)+4CO2 (g) ΔH3的化学平衡常数为4.8×10-3。若在1100℃时,测得高炉中c(CO2)=0.020mol·L-1,c(CO)=0.10mol·L-1,此时该反应(填“是”或“否”)处于平衡状态,理由是,此时υ正υ逆(填“>”、“<”或“=”)。
(3)下列试剂可以用于吸收工业尾气中的CO2的是。
a.(NH4)2CO3溶液 b.氨水 c.NaHSO3溶液 d.CaCl2溶液
A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去)。
试回答:
(1)若X为O2,则A不可能是(填选项)。
a. Si b. NH3 c. Mg d. S
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B 溶液显碱性的原因,举出C的一种用途。
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式,C的水溶液中各离子浓度由大到小顺序为。
短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
| 元素 |
结构及性质 |
| A |
A的原子半径最小 |
| X |
X原子最外层电子数是次外层的两倍 |
| D |
D是短周期中金属性最强的元素 |
| E |
E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R |
R与X同主族 |
| T |
T的负一价阴离子的核外电子排布与Ar原子相同 |
(1)R元素在周期表的位置是,化合物DT中存在的化学键是。
(2)写出E单质与NaOH溶液反应的离子方程式。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为。
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式,第二步的电离平衡常数表达式Ka2=。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是。
①I-②Fe3+③Cu2+④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式:。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下: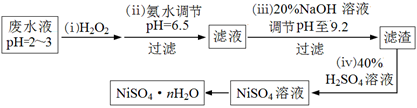
①第(ⅰ)步,加入H2O2反应的离子方程式。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为。
(1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g)△H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g)△H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为,甲与水反应可得H2,其化学方程式是:;
②写出由CaCl2通过化合反应制备CaCl的化学方程式:。