北京奥运会"祥云"火炬燃料是丙烷,亚特兰大奥运会火炬燃料是丙烯。
(1)丙烷脱氢可得丙烯。
已知: +≡+;△="156.6"-1
+≡+;△="156.6"-1
= +=;△="32.4" -1
+=;△="32.4" -1
则相同条件下,反应 =+的△=-1
=+的△=-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入和,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为;放电时,2-移向电池的(填"正"或"负")极。
(3)碳氢化合物完全燃烧生成和。常温常压下,空气中的溶于水,达到平衡时,溶液的=5.60,()=1.5×10-5 -1。若忽略水的电离及的第二级电离,则 - ++的平衡常数=。(已知:10-5.60=2.5×10-6)
- ++的平衡常数=。(已知:10-5.60=2.5×10-6)
(4)常温下,则溶液()(-)(填">"、"="或"<"),原因是(用离子方程式和必要的文字说明)。
| a |
|||||||
| b |
 |
 |
c |
d |
e |
f |
|
| g |
h |
(1)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
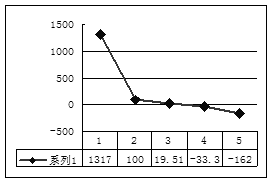
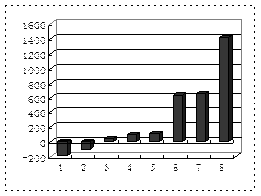
(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图,已知柱形“1”代表Ar),则其中序列“2”代表 ,“8”代表 。(均填化学式)
(3)b、c、d、e、f的氢化物的沸点直角坐标图(上右图),序列“5”氢化物的化学式为 ,序列“1”的氢化物的电子式: 。
(4)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该燃料电池的______极发生电极反应,电极反应式为____________________________。
某容积和温度不变的容器中,发生下列反应:
A(g)+2B(g) 2C(g)(正反应放热)
2C(g)(正反应放热)
回答下列问题:
(1)从A、B两气体充入容器至反应达到平衡状态,在此过程中,容器内压强____________(填“变大”“变小”或“不变”,下同),达到平衡后容器内压强___________________。
(2)使平衡体系的体积缩小,则气体A的浓度____________,气体C的物质的量___________________。
(3)化学反应达平衡状态后,加入适量的催化剂,则气体A的物质的量____________。
(4)若在平衡体系中,再充入一些气体A,则A的浓度____________,A的转化率________________________。
用注射器吸入少量NO2和N2O4的混合气体,发生如下反应(如图2—13所示)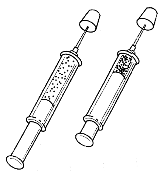
图2—13
2NO2(g) N2O4(g)
N2O4(g)
(1)当活塞迅速向外拉时,气体的颜色先变_________,后变_________;最终和最初相比,_________更深。
(2)当活塞迅速向里推时,气体的颜色先变_________,后变_________;最终和最初相比,_________更深。
I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气) C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol(乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是
。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b(乙)a>b(丙)a=b(丁)不能比较a和b的大小
作出此判断的理由是 。
将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2+O2 2CO+O2
2H2+O2 2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是___________和___________,或___________和___________。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为n(O2)平=a mol,n(CO2)平=b mol。试求n(H2O)平="______" 。(用含a、b的代数式表示)