 硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
(1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是 。
| 第1组 |
第2组 |
第3组 |
| S(单质) |
SO2、H2SO3、M、NaHSO3 |
SO3、H2SO4、、Na2SO4、NaHSO4 |
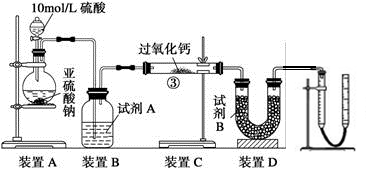
(2)某校化学学习小组用下图所示的实验装置研究SO2的性质。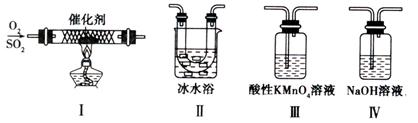
①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是 。
②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2沸点—10℃。)装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+的同时pH降低,则该反应的离子方程式是 。
③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是 。
(14分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:______________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为__________________;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
(8分)煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O  4H++2Fe2++________;
4H++2Fe2++________;
②4Fe2++O2+4H+ 4Fe3++____________;
4Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42—。
4H++2SO42—。
已知:FeS2中的铁元素为+2价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整。
(2)反应③的还原剂是________________。
(3)观察上述反应,FeS2最终转化为____________从煤炭中分离出来。
(5分)写出丁烷(C4H10)、戊烷(C5H12)的各种同分异构体并用系统命名法给其命名。
按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上。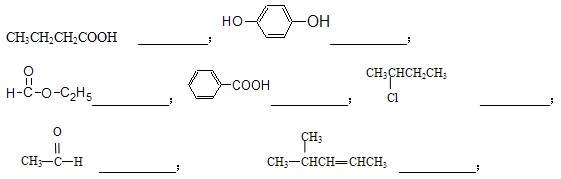
写出下列基团的名称:
| —C═C— |
─C≡C─ |
─CH3 |
─CH2CH3或─C2H5 |
| ─OH |
-COO-R |
─CHO |
─COOH |