已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D <E。其中A、B、C是同一周期的非金属元素,AC2为非极性分子。D单质与水形成的溶液具有漂白性。E的原子序数为24,ED3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)已知A、D形成的化合物分子空间构型为正四面体,而光气( )分子空间构型为平面三角形,说明原因 。光气(
)分子空间构型为平面三角形,说明原因 。光气(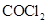 )分子中碳氧原子间的共价键的键型是 (填序号)。
)分子中碳氧原子间的共价键的键型是 (填序号)。
A.1个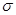 键 B.2
键 B.2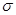 个键
个键
C.2个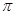 键 D.1个
键 D.1个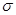 键,1个
键,1个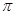 键
键
(3)写出等物质的量的D单质和SO2气体同时通入水中反应的离子方程式 。
(4)ED3与B、C的氢化物形成的配合物的化学式为 。
下列3种不同粒子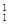 H、
H、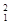 H、
H、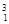 H表示______种元素,______种核素,
H表示______种元素,______种核素,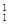 H、
H、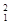 H、
H、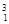 H互称为__________________。
H互称为__________________。
(10分)有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤E元素的电离能数据如下 (kJ·mol-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式__________、__________。
(2)B2A2分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
F—D |
F—F |
B—B |
F—B |
C—D |
D—D |
| 键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
试计算1 mol F单质晶体燃烧时的反应热ΔH=_____(要写单位)。
(10分)配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一提供空轨道的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(提供空轨道)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
| A.CO2 | B.H3O+ | C.CH4 | D.NH4+ |
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式: _____________________________。
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
甲: (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
乙:HOOH
化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:_____________________________________________________________。
(16分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为__________________________。
(2)B的氢化物分子的立体构型是________,其中心原子采取________杂化。
(3)写出化合物AC2的电子式________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为________。
(4)E的核外电子排布式是________,ECl3形成的配合物的化学式为________。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是________________________________________________________。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的电子式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的化学方程式及反应类型:
①,属于________________反应;
②,属于________________反应;
④,属于________________反应。