水是生命之源,也是化学反应中的主角。请回答下列问题:(下列问题
所涉及的答案可能有多种,只需答出一种情况即可)
I.水是一种电解质,发生电离会产生电子总数相同的两种微粒,其电离的方程式为
。
Ⅱ.有以下五组离子① K+、Cl-、NO3-、S2- ;② K+、Fe2+、I-、SO42- ;③ Na+、Cl-、
NO3-、SO42-;④Na+、Ca2+、Cl-、HCO3-;⑤ K+、Ba2+、Cl-、NO3-。在由水电离产生的
c(OHˉ)= 1×10ˉ13mol/L溶液中,一定不能大量共存的离子组是 (填序号)
Ⅲ.在许多反应中H2O扮演不同的“角色”。请结合所学完成下列反应
(1)H2O参与的置换反应:符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水,离子方程式为 ;
②V是水,化学方程式为 。
(2)水既不是氧化剂也不是还原剂的氧化还原反应:
A、B是中学化学常见的两种由短周期元素组成的有色气体,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,写出A、B与水反应的化学方程式:
①A + H2O ;
②B + H2O ;
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图17所示;X、Y元素具有相同的最高正化合价;Z元素是形成化合物种类最多的元素。回答下列问题: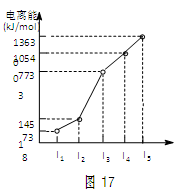
(1)已知Y元素的电负性为1.2,氮元素的电负性为3.0,则Y与氮形成的化合物的化学式为,该化合物的晶体类型为
(2)电负性:X ______Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。有关Z2H4分子的说法正确的是__________(填字母)。
| A.分子中含有氢键 |
| B.分子中既含有极性键又含有非极性键 |
| C.含有4个σ键和1个π键 |
| D.属于非极性分子 |
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构示意图如图18所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围________(填数字)个氧离子相紧邻。
(5)X的氧化物的熔点比Y的氧化物的熔点(填“高”或“低”),
原因是。
X、Y、Z、W、Q 五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和。请回答下列问题:
(1)X、W的元素符号依次为、;
(2)写出Y2的电子式____________________;
(3)WZ2与XZ2分子的空间结构分别是和,相同条件下两者在水中的溶解度较大的是(写分子式);
(4)Q在元素周期表区(填s、p、d、ds、f),其外围电子排布式为,在形成化合物时它的最高化合价为。
(1)氮元素基态原子核外未成对电子数为个;
(2)C、N、O三种元素第一电离能从大到小的顺序是_____________;
(3)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个顶点,该晶体中 X、Y、Z的粒子个数比为______________;
(4)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态
电子排布式;葡萄糖分子中碳原子杂化方式有。
(5)某化合物其组成可用CoCl3·5NH3表示。把CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。请写出表示此配合物结构的化学式(钴的配位数为6)_____________________。
现有下列物质, 用编号填空回答下列各问题:
| A.干冰 | B.金刚石 | C.氩 | D.过氧化钠 E.二氧化硅 F.氯化铵 |
(1)通过非极性键形成的晶体是 。
(2)固态时属于分子晶体的是 。
(3)由原子构成的分子晶体是 。
(4)含有非极性键的离子化合物是 。
(5)含有离子键、共价键、配位键的化合物是 。
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答: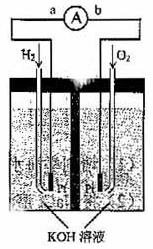
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(用a、b表示)。(2)负极反应式为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为 0.82g/cm3。用锂吸收 224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 。