一定温度下,在溶剂为1L的密闭容器内放入2molN2O4和8molNO2,发生如下反应2 NO2(红棕色) N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色) △H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为: 。
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol· L-1· s-1。
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答: 。
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率。
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动(填“正反应方向”、“逆反应方向”或“不变”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)。
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c回答)。
(1)当其物质的量浓度相同时。c(H+)由大到小的顺序是 ,pH由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 。
(3)当c(H+)相同时,物质的量浓度由大到小的顺序为 。
(4)当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为 。
有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测:
(1)该学生的操作是 (填“正确的”或“错误的”),其理由是
(2)若用此方法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是
(3)该学生以上述方式测定下列溶液的pH,无误差的是( )
| A.NaOH | B.CH3COONa | C.NaCl | D.NaHSO4 |
有两种气态烃的混合物。已知:它们都能使溴水褪色。且分子中碳原子数均小于5;1体积该混合气体完全燃烧后,可得到3.6体积二氧化碳和3体积水蒸气(气体体积均在同温同压下测定)
(1)混合物中两种烃的类别可能是________。
| A.烷,烯 | B.烯,烯 | C.烯,炔 | D.炔,炔 |
你作出上述判断的理由是____________________________。
(2)通过计算确定这两种烃的分子式以及它们在混合物中的体积比。
实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。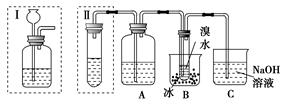
(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是___________________________。
(2)装置Ⅰ的主要缺点是______________________________________。
(3)装置Ⅱ的主要缺点是_____________________;
若选用此装置来完成实验,则应采取的措施是___________________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。
已知下列物质:
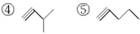
请按要求填空:
(1)写出①④的名称________、________;
(2)写出②、⑤的分子式________、________;
(3)互为同分异构体的是________。
(4)写出③与等物质的量的Br2反应的化学方程式:_______________________________。