下列说法正确的是
| A.pH=2与pH=1的硝酸中c(H+)之比为1:10 |
| B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 |
| C.0.2 mol•L-1与0.1mol/L醋酸中c (H+)之比为2:1 |
| D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液pH为2。对于该溶液下列叙述不正确的是()
| A.该温度高于25℃ |
| B.水电离出来的c(H+)=1×10-10mol/L |
| C.c(H+)=c(OH-)+c(SO42-) |
| D.该温度下加入等体积pH为12的NaOH溶液可使反应后的溶液恰好呈中性 |
下列反应的离子方程式正确的是()
A.硫酸钠稀溶液与三氧化硫反应:SO4 2-+SO3+H2O=2H++2SO42- 2-+SO3+H2O=2H++2SO42- |
| B.硫酸铝溶液和小苏打溶液混合:Al3++2HCO3-=3CO2+Al(OH)3 |
C.氯气和溴化钠反应:Cl2+2Br -=2Cl-+Br2 -=2Cl-+Br2 |
D.碳酸钡溶于醋酸:BaCO3+2CH3COOH=Ba2++2CH3COO-+ H2O+CO2 H2O+CO2 |
常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中()
A.c(HCOO-) >c(Na+) >c(Na+) |
| B.c(HCOO-)<c(Na+) |
| C.c(HCOO-)= c(Na+) |
| D.无法确定 c(HCOO-)与c(Na+)的关系 |
表示0.1mol/LNaHCO3溶液中有关微粒浓度大小的关系式,正确的是()
| A.(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B.(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| C.c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-) |
| D.c(H+)>c(H2CO3)>c(OH-)>c(HCO3-)>c(CO32-) |
体积相同的甲和乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 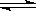 2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为:()
2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为:()
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |