G、Q、X、Y、Z均为氯的含氧化合物,现不了解其化学式,只知其一定条件下具有如下的转换关系(未配平):
(1) (2)
(2) 电解
电解
(3) (4)
(4)
将这五种化合物按其所含氯的化合价由低到高的顺序排序___ _______。(填字母)
某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32+、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题:
(1)待测液中是否含有SO42-、SO32-:。
(2)沉淀B的化学式为;生成沉淀B的离子方程式为。
(3)根据以上实验,待测液中肯定没有的离子是;
肯定存在的离子还有。
I、下列物质中属于强电解质的是;属于弱电解质的是;属于非电解质的是。(填序号)
①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
II、某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)
(2)反应中,被还原的物质是Cr2(SO4)3是
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为。
将 3a L NO2 气体依次通过盛有下列物质的容器:饱和NaHCO3 溶液、浓硫酸、固体Na2 O2 ,发生反应的化学方程式是(1)________,(2)________,(3)________。最后用排水法收集残余气体,收集到的气体是________,体积是________L。
常温下A和B两种气体组成的混合气体(A的相对分子质量大于B的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于14/3。由此可确定A为________,B为________,其理由是______________________________________。
若上述混合气体的氮和氢的质量比为7∶1,则在混合气体中A和B的物质的量之比为________,A在混合气体中的体积分数为________。
根据下列变化进行推断: 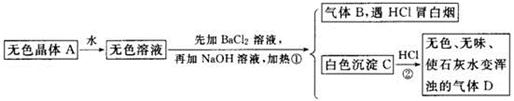
且已知对A加强热产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:
①________________________________________________________________;
②________________________________________________________________。