将0.1mol的镁铝混合物溶于100mL 2 mol·L-1的H2SO4中,然后再滴加1 mol·L-1的NaOH溶液。请回答: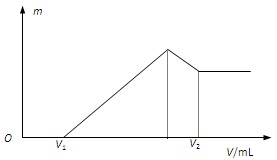
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=160mL时,则金属粉末中,n(Mg)=_______mol,V2=_______mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V (NaOH)=_______mL。
在合成氨反应中,入口气体中N2 、H2、NH3的体积比为6∶18∶1,出口气体中N2 、H2、NH3的体积比为9∶27∶8,求H2的转化率。
在密闭容器中,将0.020 mol·L-1CO和H2O(g)混合加热到773K时,达到下列平衡CO(g)+H2O(g)  CO2(g)+H2(g),已知该反应的KC=9,求CO的平衡浓度和转化率。
CO2(g)+H2(g),已知该反应的KC=9,求CO的平衡浓度和转化率。
丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2→CH3COCH2I+H++I-。
25℃时,该反应的速率由下列经验式决定:V=2.73×10-5c(CH3COCH3)c(H+)mol/(L· s)
25℃时,如果c(I2).c(CH3COCH3).c(H+)的起始浓度依次是0.01mol/L,0.1mol/L,
0.01mol/L。求:(1)反应开始时的速率是多少?
(2)当溶液中的I2消耗一半时,反应速率比开始时慢还是快?
将等物质的量的A.B混合于2L的密闭容器中,发生下列反应3A(g)+B(g) xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
(1)x的值?
(2)5min内B的平均反应速率?
(3)5min时A的物质的量浓度?
高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)==NO(g)。式通过计算说明在1200℃的条件下,此反应能否正向自发进行?估算自发进行的最低温度是多少?(已知:△H="180.50" kJ·mol-1 ,△S=247.7J·mol-1 ·K-1 )