实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。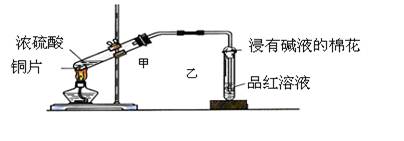
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成_____________________;
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成______________________;写出甲装置中发生的主要反应的化学方程式 。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是 _________。
(3)实验完毕后,取少量乙试管中溶液于试管中加热,现象是 ;原因是 。
(14分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
填写下列空白:
(1)甲中不含氧原子的官能团名称是________;下列试剂能与甲反应而褪色的是________(填标号)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:________________。
(3)淀粉通过下列转化可以得到乙(其中A~D均为有机物):
淀粉稀硫酸△AB浓硫酸170 ℃CDNaOH溶液△乙
A的分子式是________,试剂X可以是________。
(4)已知:
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是________________________________。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为________。
(12分)实验室制取乙烯: 浓H2SO4170 ℃C2H4↑+H2O常因温度过高而使乙醇和浓H2SO4反应生成少量SO2。有人设计下列实验以确认上述混合气体中有乙烯和SO2。
浓H2SO4170 ℃C2H4↑+H2O常因温度过高而使乙醇和浓H2SO4反应生成少量SO2。有人设计下列实验以确认上述混合气体中有乙烯和SO2。
(1)各装置盛放的试剂是:Ⅰ______,Ⅱ______,Ⅲ________,Ⅳ________(将有关试剂的序号填在横线上)。
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4溶液 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是__________________。
(3)使用装置Ⅱ的目的是________________________________________________,
使用装置Ⅲ的目的是________________。
(4)确认含乙烯的现象是________________________________________________。
某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
| 实验步骤 |
向3—4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全。 |
| 实验现象 |
产生白色沉淀 |
| 离子方程式 |
(1) |
| 小组讨论交流 |
向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液会出现什么现象 |
| 假设出现的实验现象,说明理由 |
假设Ⅰ: 无现象; 理由:反应没有限度,Ca2+沉淀完全 假设Ⅱ:(2),理由:(3) |
| 证明你的假设 |
现象:产生大量的白色沉淀 |
| 离子方程式 |
(4) |
| 实验结论 |
(5) |
某学习小组,用稀HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.00 mL、大理石用量为10.00 g。
实验设计如表:
| 编号 |
T/K |
大理石规格 |
HNO3浓度 |
| ① |
298 |
粗颗粒 |
2.00 mol·L-1 |
| ② |
298 |
粗颗粒 |
1.00 mol·L-1 |
| ③ |
308 |
粗颗粒 |
2.00 mol·L-1 |
| ④ |
298 |
细颗粒 |
2.00 mol·L-1 |
将相应的实验目的填入下列空格中:
(1)实验①和②探究对该反应速率的影响;
(2)实验①和③探究对该反应速率的影响;
(3)实验①和④探究对该反应速率的影响
在一个小烧杯里,加入20gBa(OH)2·8H2O粉末,将小烧杯放在事先已滴有3—4滴水的玻璃片上。然后加入10gNH4Cl晶体,并用玻璃棒迅速搅拌。
(1)该反应属反应。(填“吸热”或“放热”);
(2)反应的方程式:;
(3)实验中观察到的现象有:。