某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
| 实验步骤 |
向3—4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全。 |
| 实验现象 |
产生白色沉淀 |
| 离子方程式 |
(1) |
| 小组讨论交流 |
向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液会出现什么现象 |
| 假设出现的实验现象,说明理由 |
假设Ⅰ: 无现象; 理由:反应没有限度,Ca2+沉淀完全 假设Ⅱ:(2) ,理由:(3) |
| 证明你的假设 |
现象:产生大量的白色沉淀 |
| 离子方程式 |
(4) |
| 实验结论 |
(5) |
单晶硅是信息产业中重要的基础材料。通常在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃)四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
| 升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________。
(2)装置A中g管的作用是_ _____________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
_____________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?______(填 “是”或“否”),请说明理由__________。
②某同学称取5.000g残留物后,所处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气。某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下(部分导管、蒸馏水略):

(1)写出用Na2O2与浓盐酸制备氯气的化学方程式_________________________。
(2)下列装置组合最合理的是__________(填序号,需考虑实验结束撤除装置时残留有害气体的处理)。
| 组合 |
制备装置 |
净化装置 |
检验装置/试剂 |
尾气处理装置 |
| A |
③ |
② |
⑦/e |
⑤ |
| B |
③、⑥ |
① |
⑧/g |
① |
| C |
④ |
① |
⑤/e |
② |
| D |
④、⑥ |
⑤ |
⑧/g |
① |
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为:____________ 。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
① ___________________________________,② ___________________________________。
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?___________(填“是”或“否”);理由是__________________________________________ 。
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数(K)表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+ Ka2(HCO3-)=5.61×10-11
CO32-+H+ Ka2(HCO3-)=5.61×10-11
HClO H++ClO-Ka(HClO)=2.95×10-8
H++ClO-Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应, 有少量气泡产生,溶液浅黄绿色褪去;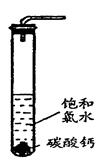 ②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
①反应后所得的溶液漂白性增强的原因是_____________________
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有_______。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。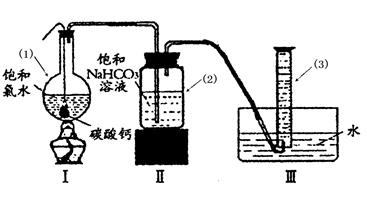
请回答:
③写出仪器(1)与仪器(3)的名称:(1)(3)
④为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是。
⑤如何准确读出量筒中气体的体积
a.___________________________________
b.上下移动量筒至量筒内液面与水槽液面相平
c._________________
下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。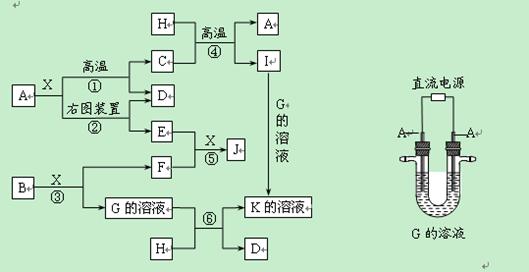
请按要求填空:
(1)写出B的电子式:______________________。
(2)写出生成E的电极反应式:___________________________________________________,反应⑤的现象是______________________________________。
(3)反应①的化学方程式是_____________________________________________________,在实验室中引发反应④的操作是__________________________________________。
(4)反应⑥的离子方程式是_____________________________________________。
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置: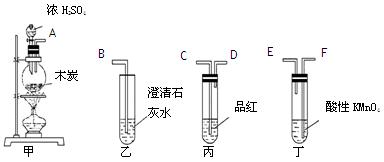
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接,接,接;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____,丙中 ______;
(3)丁中酸性KMnO4溶液的作用是;
(4)写出甲中反应的化学方程式。