有一种测定阿伏加德罗常数的方法需测定一定量NaCl晶体的体积,具体步骤为:准确称出一定量NaCl晶体置于定容仪器a中,用滴定管向仪器a中滴加某液体b 至a仪器的刻度线,即可测出NaCl晶体的体积。上述操作中的a、b分别指
| A.量筒、水 | B.容量瓶、四氯化碳 |
| C.量筒、苯 | D.容量瓶、水 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,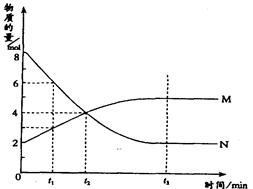
下列表述中正确的是
A.反应的化学方程式为.2 M N N |
| B.t2时,正逆反应速率相等达到平衡状态 |
| C.t1时,N的浓度是M浓度的2倍 |
| D.t3时,正反应速率大于逆反应速率 |
下列事实可证明醋酸是弱酸的是
| A.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 |
| B.用醋酸溶液做导电性实验,灯泡很暗 |
| C.0.1mol/L醋酸溶液可以使紫色石蕊试液变红 |
| D.0.1 mol/L醋酸溶液的pH=3。 |
家用炒菜铁锅用水清洗放置后出现红棕色的锈斑,在此变化过程中不发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2↓ |
| C.2H2O+O2+4e―=4OH- | D.Fe-3e―=Fe3+ |
在2L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:
3A(g)+B(g)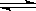 2C(g)+xD(g), 2min达到平衡时,生成了2molC,经测定D的平均反应速率为0.5mol•L-1•min-1,下列判断不正确的是
2C(g)+xD(g), 2min达到平衡时,生成了2molC,经测定D的平均反应速率为0.5mol•L-1•min-1,下列判断不正确的是
| A.x=1 |
| B.B的转化率为20% |
| C.平衡时A的浓度为1.50mol/L |
| D.达到平衡时,在相同温度下容器内混合气体的压强与反应前相等 |
下列说法正确的是
| A.反应热就是反应中放出的能量 |
| B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
| C.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
| D.由C(石墨)===C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定 |