(本题共12分)
下图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答:
1.硬质玻璃管里发生反应的化学方程式为 。
当三氧化二铬红热时,要移去酒精灯,原因是: 。
2.圆底烧瓶里的实验现象是 ,鼓入空气的作用是 。
3.实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色 。
4.实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式: 。
5.新制的三氧化二铬催化效果较好。实验室一般用加热分解(NH4)2Cr2O7的方法制三氧化二铬,反应的化学方程式为 。
6.工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后 (填一种操作名称)。实验室里保存浓硝酸的方法是 。
配制250mL 4.0mol·L-1Na2CO3溶液的实验步骤:
a、计算需要碳酸钠固体的质量。
b、称量碳酸钠固体。
c、将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入250 mL容量瓶。
d、用适量蒸馏水溶解称量好的碳酸钠固体,冷却。
e、盖好瓶塞,反复上下颠倒,摇匀。
f、继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管加蒸馏水至凹液面最低液而与刻度线相切。
(1)所需称量的碳酸钠固体的质量是。
(2)上述步骤的正确操作顺序是。
(3)供选用的仪器有:①玻璃棒;②胶头滴管;③10mL量筒;④100mL容量瓶;⑤250mL容量瓶;⑥天平;⑦50mL烧杯;应选用的仪器(填编号)
。
.如图A、B两个装置,回答下列问题: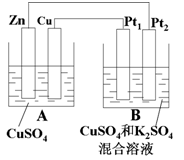
(1)A为_________池,Pt1为______极。
(2)当电路中通过0.02mol电子时,A溶液质量变化为_______________g。
(3)同时B中收集到标准状况下的气体224mL,则反应前B池中原混合溶液中Cu2+的浓度是________(设B中原混合液的体积为200mL)。
如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放100 mL6 mol/L的盐酸,烧杯乙中盛放100 mL冷水。现向烧杯甲的溶液中放入7.2 g镁条,同时向烧杯乙中放人10 g NH4Cl和20 g氢氧化钡晶体,搅拌使之溶解。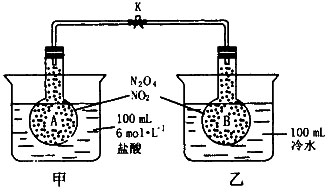
(1)A瓶中气体颜色,理由是;
(2) B瓶中气体颜色,理由是;
(10分)某研究性学习小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验。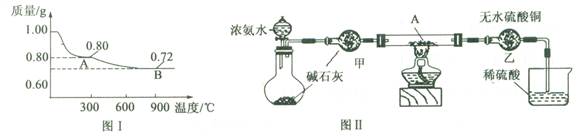
(1)取0.98 g Cu(OH)2固体加热,质量随温度变化的曲线如图1所示,产物A、B的化学式分别为和。
(2)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为。
(3)为证明产物A在加热时能与NH3反应,某同学设计了如图Ⅱ(夹持装置未画出)所示实验装置。
①简述检查该装置气密性的方法。
②实验过程中观察到两个明显现象: i直玻璃管中固体由黑色变为红色;ii装置乙中固体由白色变为蓝色。能证明产物A与NH3发生了反应的判断依据的是(填选项字母)。
a.只有i可以 b.只有ii可以 c.i或ii都可以
(12分)某无色溶液中含有K+、SO32-、SO42-、Cl、OH-,检验溶液中除OH-外其他阴离子的步骤如下图所示。
回答下列问题:
(1)填写试剂的化学式①②⑤。
(2)试剂④可能是(填选项字母)。
| A.石蕊试液 | B.硫酸铜溶液 | C.溴水 | D.品红溶液 |
(3)若试剂④是酸陛KmnO4溶液,写出气体E与酸性KmnO4溶液反应的离子方程式
。
(4)加过量试剂③的目的是。
(5)试剂②能否用试剂③代替(填“能”或“否”),理由是?
。