(本题共16分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为: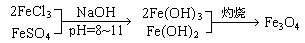
根据题意回答:
1.现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4。
2.如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL。
3.在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 。
4.有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: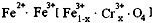 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
计算11.2 L下列气体在标准状况下的质量:
(1)N2和O2体积为4∶1的混合气体。
(2)N2的质量分数为20%的N2和O2的混合气体。
由N2和H2组成的混合气体,在标准状况下的平均密度为0.357 g·L-1。求混合气体中N2的物质的量分数。
一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为XY2(l)+3O2(g)====XO2(g)+2YO2(g),冷却后,在标准状况下,测得生成物的体积是672 mL,密度是2.56 g·L-1,求:
(1)反应前O2的体积:
(2)化合物XY2的摩尔质量:
A、B两种金属元素的相对原子质量之比是8∶9,将两种金属单质按物质的量之比3∶2组成混合物1.26 g,跟足量稀硫酸反应,放出氢气1.344 L(标准状况),这两种金属单质在反应中生成氢气的体积相等,则A的摩尔质量和B的摩尔质量各是多少?
19世纪有些化学家测定某元素R的相对原子质量时,采用的方法是:用等容积的烧瓶4只,分别盛入N2,X、Y、Z四种气态物质,操作时先把烧瓶抽成真空,充气后使压强达到1.01×105 Pa,保证气体充满整个烧瓶,并称得每只烧瓶重,减去真空的瓶重而得到瓶内气体的质量(换算成标准状况),得到的数据如下表所示,将X、Y、Z气体中某元素R的质量分数也分别用实验测定,列入下表。
| 气体 |
瓶中气体质量/g |
R(%) |
气体 |
瓶中气体质量/g |
R% |
| N2 |
0.652 |
- |
Y |
2.398 |
68.9 |
| X |
0.849 |
97.4 |
Z |
3.583 |
92.2 |
| 气体 |
瓶中气体质量/g |
R(%) |
气体 |
瓶中气体质量/g |
R% |
| N2 |
0.652 |
- |
Y |
2.398 |
68.9 |
试回答:R的相对原子质量是多少?