aA、bB、cC、dD、eE五种短周期元素,它们的原子序数有如下关系:c-b=b-a=1且 b+c=d,常见化合物E2C2与水反应生成C的单质,且溶液使酚酞试液变红。B的最高价氧化物对应水化物为强酸。下列说法正确的是
A、B与D形成的单质分别为甲、乙,非金属性:B>D,活泼性:乙>甲
B、1molE2C2与足量水完全反应生成C的单质,共转移电子2mol
C、原子半径:D>E>A>B>C
D、C的氢化物的沸点低于B的氢化物的沸点
碳原子数相同的下列各类物质,其同类异构体数目最多的是
| A.饱和链烃 | B.饱和一元醇 | C.饱和一元醛 | D.饱和一 元羧酸 元羧酸 |
分子式为CNH2NO2的羧酸和某醇酯化生成分子式为CN+2H2N+4O2的酯,反应所需羧酸和醇的质量比为1∶1,则该羧酸是
| A.乙酸 | B.丙酸 | C.甲酸 | D.乙二酸 |
有八种物质:①甲烷、②苯、③聚乙烯、④乙烯、⑤2-丁炔、⑥环乙烷、⑦邻-二甲苯、⑧环己烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是
| A.③④⑤⑧ | B.④⑤⑦⑧ | C.④⑤⑧ | D.③④⑤⑦⑧ |
可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是
| A.氯化铁溶液、溴水 | B.碳酸钠溶液、溴水 |
| C.酸性高锰酸钾溶液、溴水 | D.酸性高锰酸钾溶液、氯化铁溶液 |
下列有机物互为同系物的是
①CH2=CHCH2CH3②CH3CH2CH3③CH2=CHCH3④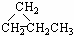
A.①和④ B.①和③ C .②和④ D.②和③
.②和④ D.②和③