某恒温密闭容器中,可逆反应A(s) 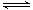 B+C(g) ΔH="Q" kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
B+C(g) ΔH="Q" kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
| A.产物B的状态可能为固态或液态 |
| B.平衡时,单位时间内A和B消耗的物质的量之比为1:1 |
| C.保持体积不变,向平衡体系中加入A(s),平衡不移动 |
| D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ |
能正确表示下列反应的离子方程式是
| A.硫酸铝溶液中加入过量氨水 Al3++3OH-= Al(OH)3↓ |
| B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-= CaCO3↓+2OH- |
| C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-= ClO-+Cl-+H2O |
| D.稀硫酸中加入铁粉 2Fe+6H+= 2Fe3++3H2↑ |
下列表示对应化学反应的离子方程式正确的是
| A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B.NO2与水的反应:3NO2+H2O=NO3-+NO+2H+ |
| C.醋酸溶液水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
下列各组离子在指定的溶液中一定能大量共存的是
| A.含有大量Fe3+的溶液:Na+、SCN-、Cl-、I- |
| B.含有大量NO3-的溶液:H+、Fe2+、Cl-、SO42- |
| C.常温下,pH=12的溶液:K+、Cl-、S2O32-、SO42- |
| D.c(H+)=0.1 mol·L-1的溶液:Na+、NH4+、SO42-、S2O32- |
将足量的SO2通入下列各溶液中,所含离子还能大量共存的是
| A.K+、SiO32-、Cl-、NO3- |
| B.H+、NH4+、Al3+、SO42- |
| C.Na+、Cl-、MnO4-、SO42- |
| D.Na+、CO32-、CH3COO-、HCO3- |
下列各组离子因发生氧化还原反应而不能大量共存的是
| A.H+、Fe2+、Cr2O72-、SO42- |
| B.Ca2+、H+、SO42-、HCO3- |
| C.Na+、Cu2+、Cl-、S2- |
| D.Fe3+、K+、SCN-、Cl- |