纳米级Cu2 O 粉末,由于量子尺寸效应,其具有特殊的光学、电学及光电化学性质,在太阳电池、传感器、超导体、制氢和电致变色、环境中处理有机污染物等方面有着潜在的应用。
Ⅰ.纳米氧化亚铜的制备
(1)四种制取Cu2O的方法如下:
①火法还原。用炭粉在高温条件下还原CuO;
②最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。
已知:N2H4(l)+O2(g)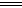 N2(g)+2H2O(l) △H="-a" kJ/mol
N2(g)+2H2O(l) △H="-a" kJ/mol
Cu(OH)2(s)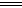 CuO(s)+H2O(l) △H="b" kJ/mol
CuO(s)+H2O(l) △H="b" kJ/mol
4CuO(s)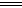 2Cu2O(s)+O2(g) △H="c" kJ/mol
2Cu2O(s)+O2(g) △H="c" kJ/mol
则该方法制备Cu2O的热化学方程式为 。
③工业中主要采用电解法:用铜和钛作电极,电解氯化钠和氢氧化钠的混合溶液,电解总方程式为:2Cu+H2O Cu2O+H2↑,则阳极反应式为: 。
Cu2O+H2↑,则阳极反应式为: 。
④还可采用Na2SO3还原CuSO4法:将Na2SO3 和CuSO4加入溶解槽中,制成一定浓度的溶液,通入蒸气加热,于100℃~104℃间反应即可制得。写出该反应的化学方程式: 。
Ⅱ.纳米氧化亚铜的应用
(2)用制得的Cu2O进行催化分解水的实验
①一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入10. 0 mol水蒸气,发生反应:
2H2O(g)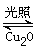 2H2(g)+O2(g) △H=+484 kJ·mol-1
2H2(g)+O2(g) △H=+484 kJ·mol-1
T1温度下不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
1.0 |
1.6 |
2.0 |
2.0 |
前20 min的反应速率v(H2O)= ;该该温度下,反应的平衡常数的表达式K= ;若T2温度下K=0.4,T1 T2(填>、<、=)
②右图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;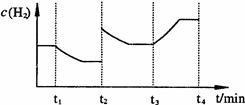
③用以上四种方法制得的Cu2O在其它条件相同下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。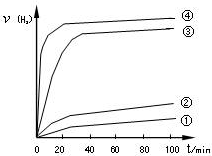
A.方法③、④制得的Cu2O催化效率相对较高
B.方法④制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有
D.Cu2O催化水分解时,需要适宜的温度
下图是无机物
在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,
是一种红棕色气体。
请填写下列空白:
(1)在周期表中,组成单质
的元素位于第周期族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为。
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是(填写序号)。
(4)反应④的离子方程式是
(5)将化合物
与
、
共融,可制得一种"绿色"环保高效净水剂
(高铁酸钾).同时还生成
和
。该反应的化学方程式是:
。
氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,与0.100 mol / L HCl标准溶液反应,完全反应共消耗标准液20.0 mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为
某一种氯化钠与氯化钾的混合物,它所含钾原子和钠原子的物质的量之比为3:1,求:(1)混合物中氯化钾的质量分数?(2)含1 mol氯原子的该混合物的质量?
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,可证明滤液中含Na+,不含K+。
由上述现象推断:
(1)该混合物中一定含有 ;一定不含有,可能含有。
(2)如要检验其是否存在,将如何操作。
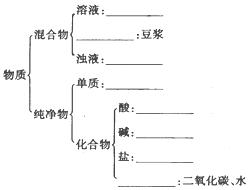
现有下列物质:
| A.豆浆, | B.食盐水, | C.铁, | D.硫酸,E.氢氧化钠固体,F.纯碱,G.泥水,H.二氧化碳,I.水。请将它们的序号或所属类别填充到下列横线上 |