对溶液中的离子反应,下列说法:①不可能是氧化还原反应;②只能是复分解反应;③可能是置换反应;④不能有分子参加。其中正确的是( )
| A.①③ | B.③ | C.①② | D.③④ |
下列有关说法或方程式正确的是()
A.用催化法处理汽车尾气中的CO和NO:CO+NO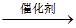 C+NO2 C+NO2 |
B.NO2与水的反应: |
C.NH4HCO3溶于过量的NaOH溶液中: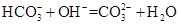 |
D.在1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、 一定能大量共存 一定能大量共存 |
下列推断正确的是()
| A.N2、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解 |
| C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层 |
| D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解 |
下列说法正确的是()
A.滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中一定无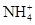 |
| B.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体 |
| C.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色 |
| D.46 g NO2和N2O4混合气体中含有原子总数为3NA,含有的分子总数为NA |
已知氨气极易溶于水,而难溶于有机溶剂CCl4。下列装置中不适宜做氨气的尾气吸收的是()
2011年中国汽车销量增长幅度很大,同时也带来了空气污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是
()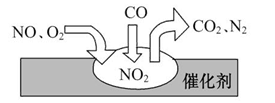
| A.反应中NO为氧化剂,N2为氧化产物 |
| B.汽车尾气的主要污染成分包括CO、NO和N2 |
| C.NO和O2必须在催化剂表面才能反应 |
D.催化转化总反应为2NO+O2+4CO 4CO2+N2 4CO2+N2 |