氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,反应的化学方程式为:2KClO3 + 4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O
(1)用双线桥表示上述反应中电子转移的方向和数目。
(2)浓盐酸在该反应中表现的性质是________(填序号)。
① 只有还原性 ② 还原性和酸性 ③ 只有氧化性 ④ 氧化性和酸性
(3)上述反应产生0.2 mol Cl2时,转移的电子数约为______________。
原电池的正极__________(填“得到”或“失去”)电子,发生__________(填“氧化”或“还原”)反应;负极__________(填“得到”或“失去”)电子,发生__________(填“氧化”或“还原”)反应。
向50mL 1.0mol/L的AlCl3溶液中加入60mL某浓度的NaOH溶液,得到1.56gAl(OH)3沉淀。则此NaOH溶液的物质的量浓度是___________mol/L
把1.0 mol·L—1 CuSO4溶液和a mol·L—1H2SO4溶液等体积混合(假设混合溶液的体积等于混合前两溶液的体积之和),混合液中c(SO42—)=1.5mol·L—1,试计算并填空。
(1)原溶液中a =______mol·L—1;混合液中c(Cu2+)=_____mol·L—1;c(H+)=_____ mol·L—1;
(2)向混合液中加入足量铁粉,经足够长时间并充分搅拌后,铁粉仍有剩余,假设反应后溶液体积不变(不考虑Fe2+被氧化),此时溶液中c(Fe2+)= ________mol·L—1。
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程: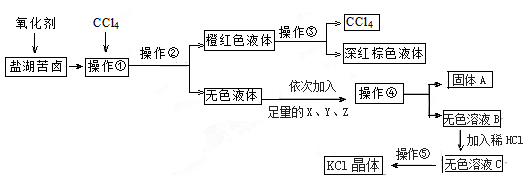
请根据以上流程,回答相关问题:
(1)操作①是_________;操作②是_________;操作⑤是_________。(填操作名称)
(2)操作②需要的主要玻璃仪器除烧杯外,还需要_________。
(3)加入足量的X、Y、Z是为了除去溶液中的杂质,它们依次是BaCl2溶液 、KOH溶液和 _____溶液。
(4)检验无色溶液B中是否含有SO42-的方法是_________。
生活中为了延长鲜花的寿命,通常会在花瓶中加入“鲜花保鲜剂”。下表是0.5L某种“鲜花保鲜剂”中含有的成分及含量,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g/mol) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.25 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.25 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖B.硫酸钾C.高锰酸钾D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为:_______ mol·L-1。
(要求用原始数据书写出表达式,不需要化简)
(3)为了研究不同浓度的“鲜花保鲜剂”的保鲜功效,需配制多份不同物质的量浓度的溶液进行研究。现欲配制480mL某物质的量浓度的“鲜花保鲜剂”,所需的玻璃仪器有:烧杯、玻璃棒、________________、____________。(在横线上填写所缺仪器的名称)
(4)配制上述“鲜花保鲜剂”时,其正确的操作顺序是(用字母表示,每个操作只用一次):;
A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G.用电子天平称量各组成成分,并把它们放入烧杯中混合
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是:__________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线