把1.0 mol·L—1 CuSO4溶液和a mol·L—1H2SO4溶液等体积混合(假设混合溶液的体积等于混合前两溶液的体积之和),混合液中c(SO42—)=1.5mol·L—1,试计算并填空。
(1)原溶液中a =______mol·L—1;混合液中c(Cu2+)=_____mol·L—1;c(H+)=_____ mol·L—1;
(2)向混合液中加入足量铁粉,经足够长时间并充分搅拌后,铁粉仍有剩余,假设反应后溶液体积不变(不考虑Fe2+被氧化),此时溶液中c(Fe2+)= ________mol·L—1。
( 共9分)、某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A。它们的转化关系如下:
已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出A、B、C、D、E、F的结构简式和名称;
A
B
C
D
E
F
(2)写出实现①、⑥转化的化学方程式,并注明反应类型。
①
⑥
( 共5分)、某有机物的键线式如下: ,该有机物分子含个碳原子,个氢原子,个氧原子,其分子式是。
,该有机物分子含个碳原子,个氢原子,个氧原子,其分子式是。
( 共8分)、某有机物中含有3个—CH3、1个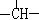 、2个—CH2—,试写出符合该条件的有机物的结构简式,并命名:
、2个—CH2—,试写出符合该条件的有机物的结构简式,并命名:
已知A、B、C、D和E都是元素 周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周
周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周 期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成
期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成 离子化合物其晶胞结构如图。
离子化合物其晶胞结构如图。
 请回答:
请回答: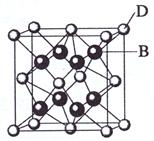
 (1)
(1) 画出A的原子结构示意图;
画出A的原子结构示意图;
(2) E的+2价离子的电子排布式为
E的+2价离子的电子排布式为 ;
;
(3) 写出C的单质与水反应的离子方程式;
写出C的单质与水反应的离子方程式;
(4)如图所示,D跟B形成的离子化合物的化学式为;鉴 别该离子化合物是否为晶体,最可靠的科学方法是,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相
别该离子化合物是否为晶体,最可靠的科学方法是,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相 对原子质量分别为b、c,则晶胞的体积是cm3(只要求列出算式)。
对原子质量分别为b、c,则晶胞的体积是cm3(只要求列出算式)。
已知A、B、C、D、E都是周期表中前 四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B
四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B 、C是同一周期的非金属元素。化合物DC形成的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为29。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所
、C是同一周期的非金属元素。化合物DC形成的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为29。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所 对应的元素符号表示)
对应的元素符号表示)
(1)AC2在H2C(C的氢化物)中的溶解度不大,其主要原因是。
(2)B的氢化物的分子空间构型是,其中心原子采取杂化。
(3)写出化合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为。
(4)向ESO4中逐滴加氨水至氨水过量,其现象为;产生此现象的原因(用离子方程式表示);。