(6分)某透明澄清溶液可能含有Na+、Fe3+、Ba2+、CO32-、SO32-、SO42-、Cl-、I-等离子中的几种,为鉴别这些离子,分别取三份少量溶液,按照以下顺序进行三个实验:
实验①:加CCl4,再滴加少量氯水,振荡后,CCl4层变为紫色;
实验②:加盐酸后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
实验③:加BaCl2溶液产生白色沉淀,过滤出沉淀,在沉淀中加入足量盐酸,沉淀不能完全溶解。
(1)分析上述3个实验,用离子符号写出每一个实验得出的结论,可不必完全填满。
实验①:含有 ;不含 ;
实验②:含有 ;不含 ;
实验③:含有 ;不含 ;(可不必完全填满)
(2)通过上述实验,不能确定是否存在的离子是 。
磷的单质和化合物是重要的化工产品。查阅资料可知:亚磷酸(H3PO3)、次磷酸(H3PO2)以及它们的盐都有较强还原性,可用于化学镀银或镀镍;亚磷酸是中强酸,它与足量的NaOH溶液反应生成Na2HPO3。试回答下列问题:
(1)Na2HPO3中P元素的化合价为_____________________;
(2)Na2HPO3是_______________(填“正盐”或者“酸式盐”),其溶液的pH________7 (填“>”、“=”或“<”)。
(3)利用次磷酸与硝酸银溶液反应进行化学镀银,反应中氧化剂与还原剂的物质的量之比为4︰1,该反应的化学方程式为:__________________。
(4)次磷酸钠(NaH2PO2)可用于化学镀镍。镀镍溶液中含Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)____Ni2+ +____H2PO2-+_____==____Ni+ + ______H2PO3-+ _______
(b)6H2PO2-+2H+ =2P+4H2PO3-+3H2↑
①请配平反应式(a);
②依据反应式(b),反应消耗掉6 mol H2PO2-时转移电子的物质的量为____________。
碱金属元素的单质和化合物在日常生活和化工生产中应用广泛。
(1)钠的原子结构示意图为______________________。
(2)过氧化钠可作为呼吸面具和潜水艇中的供氧剂。写出过氧化钠与二氧化碳反应的化学方程式:___。
(3)氯碱工业是利用电解饱和食盐水获取一系列化工产品的过程。若利用电解饱和食盐水所得的气体制100t 36.5%的浓盐酸,理论上至少需要消耗NaCl_________________ t。
(4)某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
①分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A的名称为_______。
②称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,发现Na2CO3固体完全溶解,而NaHCO3固体还有剩余,由此可以得出结论:___________。向所得溶液中滴入酚酞后,观察到的现象是________________。
③某同学为探究Na2CO3和NaHCO3与CaCl2溶液的反应,将两种固体分别配制成0.5 mol/L的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 |
预测现象 |
预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1 mL 0.5 mol/L CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32-=" " CaCO3↓。 |
| 操作2:向2mL NaHCO3溶液中滴加1 mL 0.5 mol/L CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为:___________________________。
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: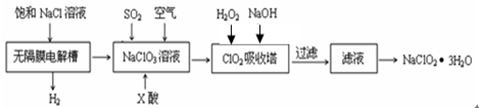
(1)反应生成ClO2气体需要X酸酸化,X酸可以为。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.H2C2O4溶液 |
(2)吸收塔内的温度不能过高的原因为。
(3)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。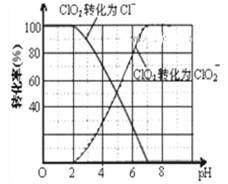
写出pH≤2时ClO2与S2-反应的离子方程式_______。
(4)ClO2对污水中CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式___________________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
A、B、C、D、E为五种短周期元素。A、B、C是原子序数递增的同周期元素,且最外层电子数之和为15,A与C可形成常见的AC2分子;D元素的某种原子中无中子;E是地壳中含量最高的金属元素。请回答下列问题:
(1)AC2分子的电子式为____________________。
(2)比较BD3与D2C的稳定性:_______比________稳定(填化学式)。
(3)五种元素的原子半径由大到小的顺序是__________________(填元素符号)。
(4)E的单质与NaOH溶液反应生成的盐的溶液与少量AC2反应的离子方程式为___________________。
(5)化合物EB溶于强碱生成氨气,写出EB与NaOH溶液反应的化学方程式______________________。
(6)工业生产的EB产品往往含有碳和氧化铝杂质,现取10 g样品置于反应器中,通入2.016L(标准状况下)O2,在高温下充分反应后,所得气体的密度是相同状况下氢气的15倍(EB不与O2反应)。该样品中含杂质碳的质量分数为______________。
H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)S的原子结构示意图为。
(2)14C可用于古代文物年代鉴定,其原子核内的中子数为_______________。
(3)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示________________________。
(4)粉末状的Si3N4对空气和水都不稳定,但将粉末状的Si3N4和适量氧化镁在一定条件下的密闭容器中热处理,可以得到对空气、水、和酸都相当稳定的固体材料,同时还可生成对水不稳定的Mg3N2,热处理后除去MgO和Mg3N2的方法是。
(5)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。若沉淀质量为7.8g,则合金的质量为______________g。
(6)将由NO和NO2组成的混合气体通入如图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2)。
已知:(i)浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
(ii)NaOH溶液与NO2能发生反应生成两种盐和水,NaOH溶液与NO不反应。
a.装置②、③、④中盛放的药品依次是_________、、。
b.能够说明实验已成功的现象是____。