A、B、C、D、E为五种短周期元素。A、B、C是原子序数递增的同周期元素,且最外层电子数之和为15,A与C可形成常见的AC2分子;D元素的某种原子中无中子;E是地壳中含量最高的金属元素。请回答下列问题:
(1)AC2分子的电子式为____________________。
(2)比较BD3与D2C的稳定性:_______比________稳定(填化学式)。
(3)五种元素的原子半径由大到小的顺序是__________________(填元素符号)。
(4)E的单质与NaOH溶液反应生成的盐的溶液与少量AC2反应的离子方程式为___________________。
(5)化合物EB溶于强碱生成氨气,写出EB与NaOH溶液反应的化学方程式______________________。
(6)工业生产的EB产品往往含有碳和氧化铝杂质,现取10 g样品置于反应器中,通入2.016L(标准状况下)O2,在高温下充分反应后,所得气体的密度是相同状况下氢气的15倍(EB不与O2反应)。该样品中含杂质碳的质量分数为______________。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一。其中炉渣的主要成分 是FeO、Fe2O3、SiO2、Al2O3。各物质有如下转化关系,请回答:
(1)写出能证明SO2具有氧化性且现象明显的化学方程式________________。
(2)用NaOH溶液吸收SO2所得NaHSO3溶液pH<7,则该溶液中存在离子的物质的量浓度由大到小的顺序是________。
(3)写出Cu2S熔炼制取粗铜的化学方程式________________________
(4)废电解液中常含有Pb2+、Zn2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,C(Zn2+): C(Pb2+)=________。[已知:Ksp(PbS)=3.4×10-28mol2·L-2、Ksp(ZnS)=1.6×10-24mol2·L-2)]
(5)写出证明溶液I中含有Fe2+的实验过程________________。
(6)Na2FeO4能杀菌净水的原因是________________。
(7)Na2FeO4和Zn可以组成碱性电池,其反应式为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)+4OH-。请写出放电时正极电极反应式________________。
研究硫及其化合物对于工农业生产具有重要意义。
(1)图Ⅰ所示一个容积为4L的密闭容器,内有可移动的隔板。一定温度(T)下,左室加入2 mol SO3,右室加入2 mol SO2和1 mol O2,在少量催化剂存在下分别发生反应:
左室:
右室:
反应达到平衡时,右室反应过程和能量关系如图Ⅱ所示。
①ΔH2=_______(含a的数学式表示);反应的平衡常数K=_________L·mol-1。
②能说明两边反应一定达到平衡的是______________(填序号)。
A.隔板不再移动
B.左右两边SO2的物质的量相等
C.左右二室中SO2与O2物质的量之比都是2∶1
③达平衡时,左室反应吸收的热量为Q1kJ,右室反应吸收的热量为Q2kJ,则Q1、Q2满足的关系是_____________(填序号)。
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
(2)高温下,炽热的Cu2S与水蒸气反应生成金属铜、H2和SO2( )。
)。
①写出该反应的化学反应方程式_____________________________________________。
②若有1 mol Cu2S参与反应,则转移电子的物质的量是_________mol。
已知:下列反应是有机合成的重要成环反应。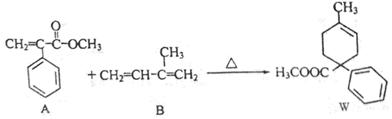
化合物A可由化合物C合成,其流程为:
(1)A+B→W的反应类型是______________,物质H的名称是_________________。
(2)由C得到D需要经过两步反应,其反应过程中需要的试剂依次是___________。
(3)写出D→E的化学方程式______________________________________________。
(4)物质X是G的同分异构体,请写出符合下列条件的X的结构简式________________。(任写一种)
①苯环上有三个取代基 ②1 mol X与足量银氨溶液反应能生成4 molAg
铜及其合金是人类最早使用的金属材料。
(1)写出铜原子价电子层的电子排布式____________;与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有_______________(填元素符号)。
(2)波尔多液是一种保护性杀菌剂。胆矾晶体是配制波尔多液的主要原料,其结构示意图可简单表示如右图:
①胆矾的化学式用配合物的形式表示为_______。
②胆矾中含有的作用力除极性共价键、配位键外还有__________。
③胆矾晶体中杂化轨道类型是sp3的原子是_____________。
(3)赤铜矿的晶胞结构如图所示,铜原子的配位数为_________。
科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与 关系如下表:
关系如下表:
 |
91∶9 |
1∶1 |
9∶91 |
| pH(25℃) |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显________性,用平衡原理解释:__________________。
②当溶液呈中性时,溶液中离子浓度的大小关系为_____________________________。