下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ· mol-1氢气的燃烧热为241.8 kJ· mol-1 |
| B.已知C(石墨,s)=C(金刚石,s);△H>0 则石墨比金刚石稳定 |
| C.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ· mol-1 则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 |
| D.己知2C(s)+2O2(g)=2CO2(g);△H12C(s)+O2(g)=2CO(g);△H2,则△H1>△H2 |
下列各组物质中,前者为混合物,后者为单质的是
| A.Na2CO3·10H2O、石墨 | B.碘酒、干冰 |
| C.氯水、液氧 | D.盐酸、水 |
用下列实验装置进行的实验中,说法正确的是()
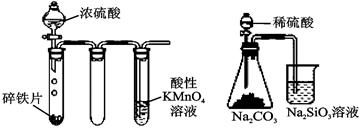

实验①实验②实验③实验④
| A.实验①:打开止水夹,烧瓶内出现红色喷泉 |
| B.实验②:铁片最终完全溶解,且高锰酸钾溶液褪色 |
| C.实验③:所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| D.实验④:烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |
下列实验中,依据实验操作及现象,得出的结论正确的是()
| 操 作 |
现 象 |
结 论 |
|
| A |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
| B |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化 但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| C |
无色溶液中滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| D |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32-或HCO3- |
甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断不正确的是
| A.与水反应的剧烈程度:甲>乙>丁 |
| B.气态氢化物的沸点:戊<己<庚 |
| C.丙和庚的核外电子数相差15 |
| D.乙单质在空气中燃烧生成离子化合物 |
化学知识在生活中有重要意义,下列说法正确的是()
| A.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| B.小苏打用于治疗胃溃疡病人的胃酸过多症 |
| C.计算机芯片所用的材料是高纯度的二氧化硅 |
| D.捕获工业排放的CO2能降低地球的温室效应 |