(1)I.短周期某主族元素M的电离能情况如右图(A)所示。则M元素位于周期表的第 族。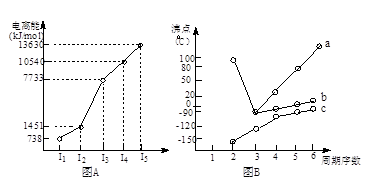
II.图B折线c可以表达出第 族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”)
III.部分有机物的熔沸点见下表:
| 烃 |
CH4 |
CH3CH3 |
CH3(CH2)2CH3 |
硝基苯酚 |
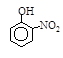 |
 |
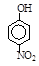 |
| 沸点/℃ |
-164 |
-88.6 |
-0.5 |
熔点/℃ |
45 |
96 |
114 |
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):
,
。
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有
________(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键。
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为 ;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为 。
某含氧有机化合物可以作为无铅汽油的抗暴剂。它的蒸气密度是同温同压下CO2的2倍,含碳的质量分数为68.2%,含氢的质量分数为13.6%,红外光谱和核磁共振显示该分子有4个甲基,通过计算推导出分子式和结构简式。
已知下列热化学方程式:
①C(s)+O2(g)=CO2(g)△H1 =-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)△H2 =-566.0 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l)△H3 =-571.6 kJ·mol-1
通过计算(要有计算过程),写出1 mol C与液态H2O反应生成CO和H2的热化学方程式。
C、N、O是中学化学常见的三种元素,请回答下列问题:
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气(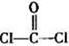 )分子中含有______个
)分子中含有______个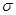 键,____个
键,____个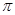 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。
(4)水的熔点比H2S的熔点高,其原因是________________。
(5)超硬材料氮化销的晶胞如图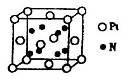 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。
运用化学反应原理研究碳、氮、硫、氯等单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)下列措施中,不利于环境保护的有(填编号)。
a.大量开采使用化石燃料
b.使用无氟冰箱、空调
c.多步行多乘公交车,少用专车和私家车
d.将工业“废气”、“废液”、“废渣”直接排放
(2)工业上的“脱碳”指的是从“脱硝”、“脱硫”后的烟气用碱液吸收并得到浓缩的二氧化碳。利用二氧化碳合成甲醇是碳减排的新方向。
①写出吸收二氧化碳的离子方程式。
②常温下,0.1mol/LNaHCO3溶液的pH>8,则溶液中c(H2CO3) _______c(CO32-) (填“>”、“<”或“=”)。
③合成的甲醇可以做为新型燃料电池的原料,若电解液是碱性的,则其负极的电极反应式为。
(3)二氧化氯(ClO2),为一种黄绿色气体,是公认的高效、广谱安全的杀菌消毒剂。工业上制备ClO2的反应原理为:4HC1(浓)+2NaClO3=2ClO2↑+Cl2↑+2H2O+2NaCl。上述反应中,产生1 mol ClO2,则被氧化的HC1为。
(4)SO2溶于水可以得到二元弱酸H2SO3(亚硫酸)。
①25℃时,将NaOH深液与亚硫酸混合至恰好中和,则混合液中各种离子浓度的大小关系为。
②25℃时,当NaOH溶液与H2SO3等物质的量混合时,发现混合液pH<7,请你简要解释其原因。
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下: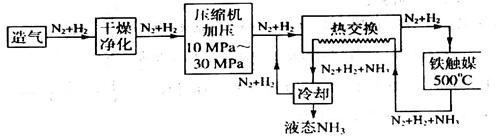
从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。