以下是某课题组设计的由烃A合成聚酯类高分子材料。 的路线:
的路线: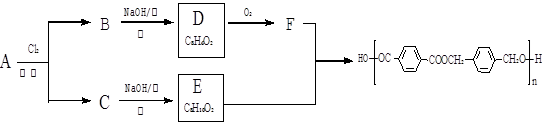
已知同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮。
根据以上信息回答:
(1)A的分子式 ,F中官能团的名称是 。
(2)化合物D的结构简式是 ,由B生成D的反应过程中生成的不稳定中间体的结构简式是 ,该中间体生成D的反应类型为 。
(3)E与F反应的化学方程式是 ,反应类为 。与E具有相同官能团的含苯环的同分异构体有(写结构式) 。
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):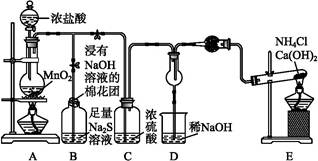
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因 。
(4)D中干燥管中出现的现象及化学方程式 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2>S,用一种相关事实说明 。
某一种胃药中的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液
②取一粒(药片质量相同) 0.2 g的此胃药片,磨碎后加入20.0 mL蒸馏水
③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,用去V mL达滴定终点
④加入25 mL 0.1 mol·L-1的HCl溶液
(1)写出实验过程的步骤(写编号顺序) 。
(2)下图所示容器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是(填序号) ,配制上述溶液还需要的玻璃仪器是 (填仪器名称)。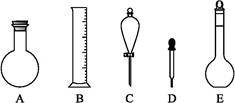
(3)配制上述溶液应选用的容量瓶规格是(填字母) 。
| A.50 mL 50 mL |
| B.100 mL 100 mL |
| C.100 mL 150 mL |
| D.250 mL 250 mL |
(4)写出有关的化学反应方程式: 、 。
(5)每粒胃药中含碳酸钙的质量为 g。
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)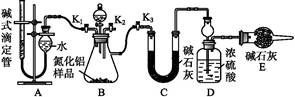
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为n g,滴定管的读数为a mL。
②称取m g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为p g。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”“偏小”或“无影响”)。
③Al4C3的质量分数为 。(该实验条件下的气体摩尔体积为Vm)
硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
(1)操作Ⅰ具体为 、 、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是 (填字母代号)。
| A.灼烧过程中部分氧化铜被还原 |
| B.灼烧不充分,铜未被完全氧化 |
| C.氧化铜在加热过程中分解生成铜 |
| D.该条件下铜无法被氧气氧化 |
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量 (填化学式,下同),调节pH=4,生成 沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2 NaNO3+NaNO2+H2O)。
NaNO3+NaNO2+H2O)。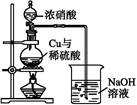
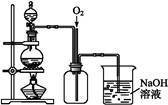
图1图2
烧瓶内发生反应的离子方程式为 ;
图2是图1的改进装置,其优点有:① ;② 。
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl,遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 ,F中碱石灰的作用是 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通入干燥CO2的作用是 。通过控制K1、K2能除去A、B装置中的空气,具体的方法是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。