有一化学样品Na2SO3,可能含有NaCl、Na2SO4、KNO3、K2CO2、K2SO4中的一种或几种杂质,某实验小组利用图12提供的装置确定该样品的成分及Na2SO3的质量分数。称此样品6.30g,加入6.0mol·L-1的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钻玻璃观察,滤液的焰色反应无紫色。请回答下列问题:
(1)溶液X是 ,煤油的作用是 。
(2)若实验中加入硫酸溶液的体积为5.00mL,则样品中Na2SO3的质量分数是 ,
写出有关离子方程式 。
(3)结合已提供的实验仪器,设计实验(实验仪器自选)如何正确测出气体的体积,简述操作步骤:
。
(4)说明一定含有硫酸钠的依据:
 。
。
为了比较氯和碘单质氧化性的强弱,可先制取氯气,并将氯气通入碘化钾淀粉溶液中。下图是本实验所需的仪器和药品:图中A.B.C.D.E.F分别表示玻璃导管或仪器接口。
请回答下列问题:
(1)气体流向从左到右。实验前,上述各仪器装置的正确连接顺序是(填各接口的字母符号);D从E处插入烧瓶后,_____________接_____________,_____________接_____________。
(2)写出制备 的反应方程式:______。
的反应方程式:______。
某学生用含0.4molHCl的浓盐酸和足量MnO2反应制 得到的
得到的 总小于
总小于 (标况下)为什么?___________________
(标况下)为什么?___________________
(3)实验完成后,装置1中的溶液为_____________色,再向其中滴加足量 溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ .
溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______ .
(4)工业上,可用 制备漂白粉,请写制备漂白粉的离子反应方程式:
制备漂白粉,请写制备漂白粉的离子反应方程式:
____________。
小明为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质,装置图如下:
(1)写出甲中反应的离子方程式:;
乙中的现象是____________可证明NO2的氧化性;
在丙中鼓入空气后现象是__________可证明NO的还原性。
(2)实验前丙中充满水的作用是(用反应方程式和简要文字回答)。
(3)小华对小明的实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是___________________________。
你认为怎样才能准确证明NO2的氧化性?
_____________________________________。
(简要回答出原理和现象即可)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)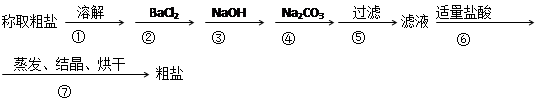
(1)判断BaCl2已过量的方法是
。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
。
(4)为检验精盐纯度,需配制250 mL 0.2 mol/L NaCl(精盐)溶液,题图是该同学转移溶液的示意图,图中的错误是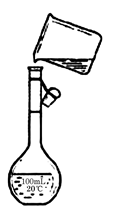
。
(12分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。某化学探究学习小组选用适当的化学试剂和实验用品,用下图中实验装置,A是制取CO2的装置,D中装有过氧化钠,进行实验来证明过氧化钠可作供氧剂。
(1)填写表中空格:
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
||
| E |
饱和NaOH溶液 |
(2)若无C装置,可能发生的干扰反应的化学方程式为。
(3)试管F中收集满气体并从水中取出后,下一步实验操作是。
(12分)某化学探究学习小组同学在实验室中配制100mL 3.6 mol·L-1的稀硫酸。
(1)若采用18 mol·L-1的浓硫酸配制溶液,需要浓硫酸的体积为。
(2)下列实验步骤是配制溶液所必需的步骤,请使用各步骤的编号按照实验操作时的顺序进行排序(只填各步骤的编号)。
①溶解并恢复至室温;②定容;③计算;④转移;⑤量取;⑥洗涤并转移;⑦反复倒转摇匀。
(3)实验中除了需要50mL量筒、烧杯、玻璃棒外,还需要的仪器有
。
(4)定容的正确操作是
。
(5)该小组在实验室中发现了一张注射用质量分数为5%的葡萄糖(分子式为C6Hl2O6,相对分子质量为180)溶液的标签,如下图所示。
则该溶液中含水g;该溶液的物质的量浓度为(小数点后保留2位数)。