近年来用红外激光技术研究液氢时,发现分子间作用力也可引起微粒间的反应,在液氢中氢分子和质子形成的H3+离子,其构型是等边三角形,属于二电子三中心离子,同时H3+还可进一步形成Hn+,下列判断不正确的是( B )
A.H3+的电子式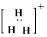 |
| B.H3+可在液氢中形成H4+、H5+、H6+ |
| C.H3+可在液氢中形成H5+、H7+、H9+ |
| D.每个H3+微粒中含有3个质子 |
用NA表示阿伏加德罗常数,下列说法中,正确的是()
| A.常温常压下,3.0 g乙烷中含有的碳氢键数为0.7 NA |
| B.标准状况下,22.4 L C2H5OH中含有的氢原子数为6 NA |
| C.常温常压下,92 g的 NO2和N2O4混合气体含有的原子数为 6 NA |
| D.标准状况下,由Na2O2制得11.2 L O2,反应转移的电子数为0.5 NA |
水热法制备Fe3O4纳米颗粒的总反应为: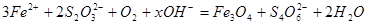 。下列说法正确的是()
。下列说法正确的是()
| A.硫元素被氧化,铁元素被还原 |
| B.Fe2+、S2O32-都是还原剂 |
| C.x=2 |
| D.每生成1 mol Fe3O4,则转移电子数为3 mol |
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是()
| A.体积相等时密度相等 | B.原子数相等时具有的中子数相等 |
| C.体积相等时具有的电子数相等 | D.质量相等时具有的质子数相等 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是()
A. 元素A、B组成的化合物常温下一定呈气态
B.元素C、D的最高价氧化对应的水化物之间不能发生反应
C. 化合物AE与CE含有相同类型的化学键
D. 工业上常用电解法制备元素C、D的单质
某溶液中含有下列六种离子:①HCO3-②SO32- ③Na+ ④CO32-⑤NH4+ ⑥NO3-,向其中加入一定量Na2O2后,溶液中离子浓度基本保持不变的是( )
| A.只有⑥ | B.④⑥ | C.③④⑥ | D.①②⑤ |