炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2 L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)  2CO(g) ΔH=Q kJ·mol-1。右图为CO2、CO的物质的量n随时间t的变化关系图:
2CO(g) ΔH=Q kJ·mol-1。右图为CO2、CO的物质的量n随时间t的变化关系图:
下列说法正确的是( )
| A.0~1 min,v(CO)=1 mol·L-1·min-1;1~3 min时,v(CO)=v(CO2) |
B.当容器内的压强不变时,反应一定达到平衡状态,且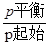 <1 <1 |
C.3 min时温度由T1升高到T2,则Q>0,再达平衡时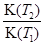 =4.7 =4.7 |
| D.5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化, |
目前工业上用乙烯制乙醛的过程分为三步进行:
①CH2=CH2+PdCl2+H2O → CH3CHO+2HCl+Pd
②Pd+2CuCl2= PdCl2+2CuCl
③2CuCl+1/2O2+2HCl=2CuCl2+H2O
对于整个生产过程,下列叙述正确的是
| A.CH2=CH2是还原剂,PdCl2是氧化剂 |
| B.CuCl是还原剂,O2是氧化剂 |
| C.乙烯是还原剂,O2是氧化剂 |
| D.Pd和CuCl都是催化剂 |
下列反应的化学方程式(或离子方程式)错误的是
A.乙醛与银氨溶液反应 CH3CHO+2[Ag(NH3)2]OH  CH3COONH4+2Ag↓+3NH3+H2O CH3COONH4+2Ag↓+3NH3+H2O |
B.酯的水解反应 CH3CH2OOCCH3+H218O  CH3CH2OH+CH3CO18OH CH3CH2OH+CH3CO18OH |
| C.苯酚与氢氧化钠溶液反应 C6H5OH+OH—→ C6H5O—+H2O |
| D.醋酸溶解水垢(主要成分是碳酸钙)CO32-+CH3COOH →CO2↑+CH3COO-+H2O |
 需经过下列哪种合成途径( )。
需经过下列哪种合成途径( )。
| A.消去→加成→消去 | B.加成→消去→脱水 |
| C.加成→消去→加成 | D.取代→消去→加成 |
下列说法中正确的是
| A.苯中少量的苯酚可先加适量的浓溴水,使之生成三溴苯酚,再过滤除去 |
| B.在洁净的试管中加入2% AgNO3溶液1~2 mL,逐滴加入2%稀氨水,边滴边振荡,至产生的沉淀恰好溶解时得到的即是银氨溶液 |
| C.BaCl2属于重金属盐,能使蛋白质变性,所以误吞BaCl2可以服用Na2CO3解毒 |
| D.淀粉和纤维素的组成都是(C6H10O5)n ,两者互为同分异构体,水解最终产物都是葡萄糖 |
下列化学变化中,反应物的总能量低于生成物的总能量的是()
A.2H2 +O2 2H2O 2H2O |
B.CaO + H2O= Ca(OH)2 |
C.CaCO3 CaO + CO2↑ CaO + CO2↑ |
D.CH3CH2OH(酒精)+ 3O2 2CO2 + 3 H2O 2CO2 + 3 H2O |