下列指定反应的离子方程式正确的是
| A.铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B.氯气和水的反应:Cl2+H2O=2H++Cl-+ClO- |
| C.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O |
| D.将过量二氧化硫通入氨水中:SO2+NH3·H2O=HSO3-+NH+4 |
下列操作不能达到目的的是( )
| 选项 |
目的 |
操作 |
| A |
配制100 mL1.0 mol·L-1CuSO4溶液 |
将25 g CuSO4·5H2O溶于100 mL蒸馏水中 |
| B |
除去KNO3中少量NaCl |
将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C |
在溶液中将MnO4—完全转化为Mn2+ |
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D |
确定NaCl溶液中是否混有Na2CO3 |
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
下列说法中正确的是( )
| A.干冰、液态氯化氢都是电解质 |
| B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| C.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 |
| D.Na2O2晶体中既含有离子键又含有共价键 |
下列叙述正确的是( )
| A.1.00 mol NaCl中含有6.02×1023个NaCl分子 |
| B.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| C.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
| D.电解58.5 g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠 |
某同学研究铝及其化合物的性质时设计了如下两个实验方案:
方案①:2.7gAl  X溶液
X溶液  Al(OH)3沉淀
Al(OH)3沉淀
方案②:2.7gAl  Y溶液
Y溶液 Al(OH)3沉淀
Al(OH)3沉淀
NaOH溶液和稀盐酸的浓度均是3 mol/L,下图是向X溶液中加入NaOH溶液和向Y溶液中加入稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是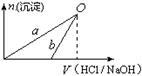
| A.X溶液的溶质为AlCl3,Y溶液的溶质为NaAlO2 |
| B.b曲线表示的是向X溶液中加入NaOH溶液 |
| C.在O点时两方案中所得溶液的物质的量浓度相等 |
| D.a、b曲线表示的反应都是氧化还原反应 |
已知:下表为25℃时某些弱酸的电离平衡常数。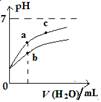
| CH3COOH |
HClO |
H2CO3 |
| Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.4×10-7 Ka2=4.7×10-11 |
右图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+ H2O =HClO+CO32-
C.图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图像中a点酸的总浓度大于b点酸的总浓度