以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)写出燃烧黄铁矿的化学方程式 。
当有6mol SO2生成时,转移电子 mol。
(2)进入接触室的气体中含标准状态下1120m3SO2气体,达平衡后放出热量为4.728×106kJ,此时SO2转化率为96%。该反应的热化学方程式为 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
e.吸收塔用水作吸收剂
(4)某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品充分灼烧,生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,再用0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则样品中FeS2的质量分数是多少?(假设杂质不参加反应)
(5)该生产过程中产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是 。(填字母)
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀H2SO4 |
| C.碘水、淀粉溶液 | D.氨水、酚酞 |
材料科学是近年来与化学有关的科学研究热点。某新型无机非金属材料K由两种非金属元素组成。它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。它是以中学化学中常见物质为原料来生产的。下图虚线框内的其它转化是为探究C的组成而设。G、F、H均为难溶于水的白色固体;图中C、H、K均为含A元素。其余物质均为中学化学中常见物质。
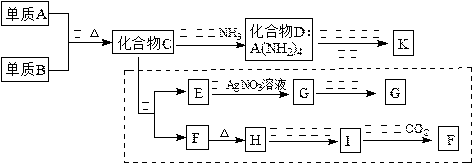 |
请回答下列问题:
(1)指出K可能所属的晶体类型,K中含有的化学键类型为。
(2)写出化学式:化合物C;化合物F。
(3)写出反应③的化学方程式:。
(4)写出反应⑤的离子方程式:。
(5)化合物K与化合物C类似,也能在一定条件下与水反应生成两种化合物,请写出K与水反应的化学方程式:。
(每空3分,共21分)如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒。
②乙池中阳极的电极反应式是____________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式是___________________。
②甲池中碳极的电极反应式是______________。
③将湿润的淀粉—KI试纸放在乙池碳极附近,发现试纸变蓝,过一段时间后又发现蓝色退去。这是因为过量的Cl2又将生成的I2氧化。若反应的Cl2和I2物质的量之比为5∶1,且生成两种酸,该反应的化学方程式是_______________________________。
④若乙池转移0.02mol e-后停止实验,池中溶液体积是200mL,则反应后溶液的pH=。
(每空3分,共12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题: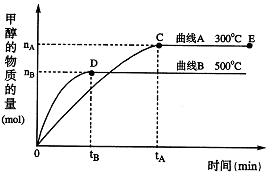
(1)在500℃,从反应开始到刚好达到平衡,氢气的平均反应速率ν(H2)=(用图中相应字母表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的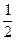 ,下列有关该体系的说法正确的是(填序号)
,下列有关该体系的说法正确的是(填序号)
a氢气的浓度减少b正反应速率加快,逆反应速率变慢,平衡正向移动
c甲醇的物质的量增加 d重新平衡时c(CO)/c(CH3OH)增大
(3)从反应的方向判断,正向进行的反应(填序号:
| A.高温时 | B.低温时 | C.任何温度都能 | D.任何温度都不能)自发进行。 |
(4)在不改变反应物用量的情况下,提高CO的转化率采取的措施是
(答两点即可)
(每空3分,共15分)原子序数依次增大 的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两
的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两 种氧化物。
种氧化物。 (1)W元素在元素周期表的位置为
(1)W元素在元素周期表的位置为 ,用电子式表示其气态氢
,用电子式表示其气态氢 化物。
化物。 (2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
。 (3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是 。
。
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为。
(每空3分,共12分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下: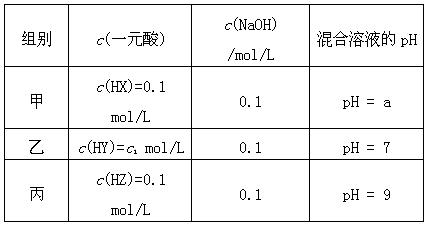
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY为强酸,则HY溶液的pH=。
(3)丙组实验发生反应的离子方程式为,
所得溶液中由水电离出的c(OH-) =mol/L。