水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
下列叙述正确的是________________。
| A.不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗。 |
| B.甲、乙两种有机物具有相同的相对分子质量和不同结构,则甲和乙一定是同分异构体。 |
| C.浓溴水滴入苯酚溶液中立即产生2,4,6-三溴苯酚的白色沉淀。 |
| D.溴的苯溶液中加少量铁粉后会剧烈反应,并放出大量的热,但该现象不能说明苯和溴的取代反应就是放热反应。 |
E.分离沸点相差30℃以上的混溶液体,应采用的方法是蒸馏
F.实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃。
G.除去混在苯中的少量苯酚,加入过量溴水,过滤。
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)元素②在周期表中的位置是
(2)在①~⑨元素中,金属性最强的元素是,非金属性最强的元素是。(均填元素符号)
(3)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,请写出反应的化学方程式__________
(4)⑤与⑥两元素最高价氧化物的水化物相互反应的化学方程式为____________________
(5)③的氢化物的电子式为__________________
①④⑤三种元素形成的最简单一种化合物含有的化学键类型有
把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题: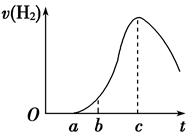
(1)曲线由O →a段不产生氢气的原因是___________________________________
有关反应的化学方程式为_________________________________
(2)曲线a→c段,产生氢气的速率增加较快的主要原因是_________________________
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________
(4)该反应若使用催化剂,可使H2产量增多吗______________(填“会”或“不会”)。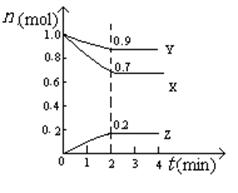
(5)某温度时,在2L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
由图中的数据分析,该反应的化学方程式为。
反应从开始至2min末,Z的平均反应速率为。
(Ⅰ)下列装置能组成原电池的是_____________ (填序号)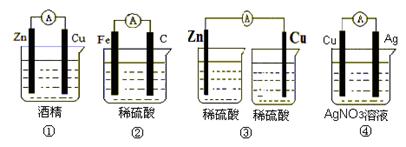
(Ⅱ)如上图④所示,若是原电池,请回答下列问题(若不是原电池,则不用回答)。
(1)负极材料是_______________________
(2)正极的电极反应式为________________________
(3)电池工作时总反应的离子方程式是____________________________
(4)导线中电子的流向________________________________
(5)阳离子的移动方向___________________________________
(6)该装置将能转化为能。
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3。
(1)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率、。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率、。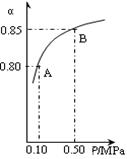
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有(填字母序号,多选倒扣分)。
A.升高温度B.降低温度
C.增大压强D.加入催化剂
E.移出氧气
(3)某温度下,上述反应中SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。判断:平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”)。