【化学–选修3:物质结构与性质】
X、Y、Z、W四种元素原子序数依次增大且均小于36。 Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒, W基态原子有10个价电子。回答下列问题(以下问题均以推知元素符号作答):
(1)若 YX3与X2Z﹑YX2-与ZX-﹑Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式
⑵已知0℃时X2Z的密度为a g/cm3,其晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因是 。两个X2Z分子间的最近距离为 pm(用a和NA表示)。 已知X2Y的升华热是51 kJ/mol,除氢键外,X2Z分子间还存在范德华力(11 kJ/mol),则X2Z晶体中氢键的“键能”是 kJ/mol。
⑶ WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)2·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为 ,其核外电子有 种运动状态。
②尿素分子中碳原子的杂化方式为 ,1 mol尿素分子中含有的σ键数为 。
③YZ3-的空间构型 。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6∶91。若该晶体的化学式为WxZ,则x= 。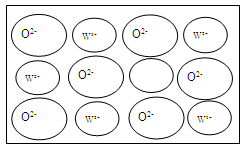
A与芳香族化合物B在一定条件下反应生成C,进一步反应生成抗氧化剂阿魏酸。
A的相对分子质量是104,1 molA与足量NaHCO3反应生成2 mol气体。已知: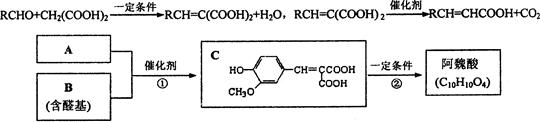
(1)C可能发生的反应是(填序号)。
a.氧化反应 b.水解反应 c.消去反应 d.酯化反应
(2)等物质的量的C分别与足量的Na、NaHCO3、NaOH反应时消耗Na、NaHCO3、NaOH的物质的量之比是。
(3)A的分子式是。
(4)反应①的化学方程式是。
(5)符合下列条件的阿魏酸的同分异构体有种,写出其中任意一种的结构简式。
①在苯环上只有两个取代基;②在苯环上的一氯取代物只有两种;
③1 mol该同分异构体与足量NaHCO3反应生成2 molCO2。
A、B、C三种香料的结构简式如下。
(1)B的分子式是,C中的含氧官能团名称是。
(2)A在一定条件下可转化为一种高分子化合物,该化合物的结构简式是。
(3)C经过下列反应得到E。在一定条件下,两分子E之间发生反应生成六元环酯F。
E→F的化学方程式是。
A、B、C属于周期表前4周期的元素,它们的原子序数依次增大。A、B属于同一周期,A、C是生活中常见的金属元素。C的原子序数是A的2倍,B的单质常温下为黄色粉末。
(1)C在周期表中位于周期族。
(2)在加热条件下B单质与C单质反应的化学方程式是。
(3)A的氧化物是某矿物的主要成分,由该矿物提取A元素的第一步是用NaOH溶液处理矿物,使A元素变为可溶性盐,该反应的离子方程式是。
(4)B与C形成的化合物CB2,在有水存在的条件下用氧气氧化该化合物,得到强酸性溶液,低温下从该强酸性溶液中还可结晶出浅绿色的C的低价盐,该氧化还原反应的化学方程式是。
A、B、C、D为四种由短周期元素形成的化合物,它们的焰色反应均为黄色,并有下列转化关系。A中既含有离子键又含有非极性共价键,D含四种元素。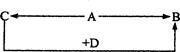
(1)A的电子式是。
(2)把1 molCO2通入含2 molC的溶液后,溶液中各离子浓度由大到小的顺序是。
(3)1 molA与2 molD固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体是(用化学式表示)。
已知在一定条件下3分子乙炔可发生加成反应生成苯: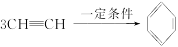
试预测下列物质3分子加成后的产物。
(1)3H—C≡ (2)3
(2)3
