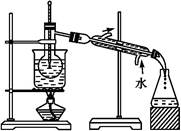
某学校课外活动小组针对教材中铜与浓硫酸反应,提出了“能够与铜反应的硫酸的最低浓度是多少?”的探究课题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液。
请根据实验回答问题:
(1)首先根据下图所示,组装实验装置,并在加入试剂前先进行 操作。

(2)烧杯中用NaOH溶液吸收的物质是
(填化学式),利用倒置的漏斗而不是将导气管直接伸入烧杯中的目的是: 。
(3)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的 (填仪器名称)起到了确保硫酸溶液体积保持不变的作用。
(4)将充分反应后的烧杯取下,向其中加入足量的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量固体的质量为13.98g,请计算能与铜反应的硫酸的最低浓度是 。
(5)有同学提出在上面⑷中可以不必加入双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析 (填“需要”或“不需要”)加入双氧水,说明原因: 。
下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置: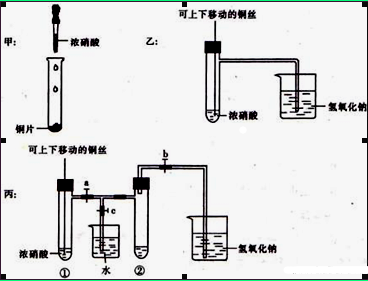
(1)甲、乙、丙三个装置中共同发生的化学方程式是。
(2)和甲装置相比,乙装置的优点是可以控制反应的开始与停止,还可以。
(3)为了进一步验证NO2和水的反应,当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进人②试管,应如何操作?
某课外兴趣小组为探究铜跟浓硫酸反应情况,用下图所示装置进行实验。已知:①SO2难溶于饱和亚硫酸氢钠溶液;②SO2能与酸性高锰酸钾溶液发生氧化还原反应使之褪色(化学方程式为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4)。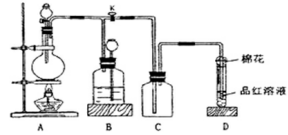
回答下列问题(注:E为止水夹,F为旋塞):
(1)检查A装置的气密性的方法。
(2)装置A中反应的化学方程式为。
(3)装置D中试管口放置的棉花应蘸有NaOH溶液,
其作用是。
(4)装置B具有贮存气体的作用。当D处有明显的现象后,关闭旋塞F并移去酒精灯,由于余热的作用,A处仍有气体产生,此时B中的现象是,B中应放置的液体是(填字母)。
| A.水 | B.饱和NaHSO3溶液 | C.酸性KMnO4溶液 | D.NaOH溶液 |
(5)该小组学生做了如下实验:取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中没有铜片剩余。往反应后的溶液中加入足量的BaCl2溶液,获得沉淀3.495 g;产生的气体恰好使200ml 0.01mol·L-1的酸性高锰酸钾溶液褪色,则实验中取用的硫酸的物质的量为。
某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验(实验室制取氯气的反应为MnO2 + 4 HCI(浓) MnCl2+ C12↑+ 2 H2O):
MnCl2+ C12↑+ 2 H2O):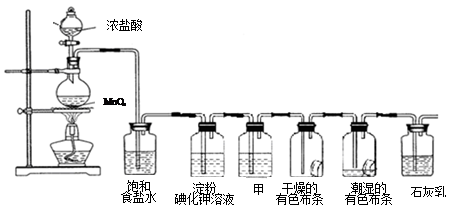
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是_________,反应的离子方程式____________。
(2)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放________(填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为___________________。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2______________L。
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: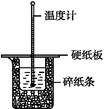
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”)。所求中和热(填“相等”或“不相等”),简述理由:。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会,用50 mL 0.50 mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会(均填“偏大”“偏小”或“无影响”)。
碘是人体必需的元素之一,海洋植物如海带、海藻中含有丰富的、以化合态形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)步骤④除了加入过量Cl2,下列氧化剂最好选用 (填代号)。
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是____________________________。
(5)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 。
(6)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。