.(13分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+  O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
反应:Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ.反应1/3Fe2O3(s)+ CO(g) 2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1 kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2 kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3 kJ热量 |
则下列关系正确的是________.
A c1=c2 B.2Q1=Q3 C. 2α1=α2 D.α1+α2=1
E. 该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l mol CO、2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式___ ____。
(18分) 完成下列空白。
(1)“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,下图是异辛烷的球棍模型,则异辛烷的系统命名为_________ ___ _。
(2)写出下列反应的化学方程式
①2,5-二甲基-2,4-己二烯与足量氢气加成:;
②2-甲基-2-丁烯加聚反应_________________
③甲苯在一定条件下生成三硝基甲苯:________________________________
④实验室制备乙烯:________________________________
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr → CH3CHBrCH3+CH3CH2CH2Br
(主要产物) (次要产物)
A是一种不对称烯烃,与HBr加成时,生成的主要产物为B,且B中仅含有4个碳原子、1个溴原子、1种氢原子。则B的结构简式为 ,A的结构简式为
在短周期元素中,A元素M电子层上有7个电子,C元素与A元素同主族,B元素与A元素位于同一周期,B元素的原子最外电子层只有1个电子。
(1)画出B元素的原子结构示意图______________。
(2)C、B两元素形成化合物的化学式是___________,其形成过程用电子式表示为______________。
(3)写出B的两种氧化物的电子式:、。
(4)比较A元素的氢化物与C元素的氢化物稳定性:(填化学式及“<、>或=”)原因为:。
(9分)把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1盐酸溶液的烧杯中,该铝片与盐酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示,回答下列问题:
(1)曲线O→a段不产生氢气的原因,用化学方程式解释为。
(2)曲线b→c段产生氢气的速率增加较快的主要原因是。
(3)向溶液中加入下列物质,能加快上述化学反应速率的是 。
| A.蒸馏水 |
| B.改用铝粉 |
| C.饱和氯化钠溶液 |
| D.浓盐酸 |
E.少量硫酸铜溶液
(12分)(1)将锌片和银片用导线相连浸入稀硫酸中组成原电池。该电池中负极发生________反应(填“氧化”或“还原”);溶液中的H+移向________(填“正极”或“负极”)材料。
(2)电能是现代社会应用最广泛的能源之一。下图所示的原电池装置中,其负极是__________,正极上能够观察到的现象是____________________________,正极的电极反应式是______________。原电池工作一段时间后,若消耗锌6.5g,则放出气体_______g。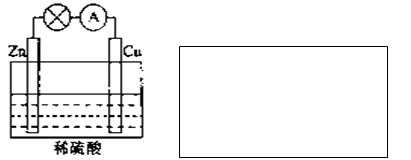
(3)利用下列反应:Fe+2Fe3+=3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向。
(1)已知断开1 mol N≡N键需要946 kJ的能量,断开1 mol H—H键需要436 kJ的能量,生成1 mol N—H键放出391 kJ的能量,试计算生成2 mol NH3时会________(填“放出”或“吸收”)________kJ能量。
(2)当在相同的条件下向容器中充入1 mol N2和3 mol H2时,它们反应对应的热量________(填“大于”、“等于”或“小于”)你所计算出的值,原因是__________________________。