X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y核外电子数的一半,Y与M可形成化合物 。下列说法正确的是( )
。下列说法正确的是( )
| A.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
C.YX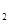 、M 、M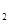 Y都是含有极性键的分子 Y都是含有极性键的分子 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液,在溶液中逐滴滴加稀盐酸。下列离子方程式与事实不相符的是
| A.HCO3-+CO32-+3H+→2CO2↑+2H2O |
| B.HCO3-+3CO32-+7H+→4CO2↑+4H2O |
| C.2HCO3-+CO32-+4H+→3CO2↑+3H2O |
| D.CO32-+H+→HCO3- |
40℃时,在氨-水体系中不断通入CO2,各种离子变化趋势如下图所示。下列说法不正确的是
| A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) |
| B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
C.随着CO2的通入, 不断增大 不断增大 |
| D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列判断合理的是
| A.元素W分别与X、Y、Z形成的化合物都是离子化合物 |
| B.四种元素简单离子的半径:X < Y < Z < W |
| C.Z与其他三种元素形成的常见化合物中有离子晶体、原子晶体和分子晶体 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
某温度下,向一定体积0.1mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=―lg[OH―])与pH的变化关系如图所示,则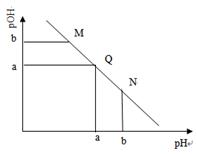
| A.M点所示溶液的导电能力强于Q点 |
| B.M点和N点所示溶液中H2O的电离程度相同 |
| C.N点所示溶液中c(CH3COO―)>c(Na+) |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+ 3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
A.若 > > ,则正反应是放热反应 ,则正反应是放热反应 |
B.达到平衡时 的转化率大小为:b>a>c 的转化率大小为:b>a>c |
C.若 > > ,达到平衡时b、d点的反应速率为 ,达到平衡时b、d点的反应速率为 > > |
D.在 和 和 不变时达到平衡, 不变时达到平衡, 的物质的量大小为:c>b>a 的物质的量大小为:c>b>a |