【化学-物质结构与性质】
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用。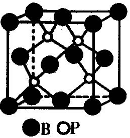
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为 ,B原子的杂化类型为 。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图示意的是磷化硼的晶体结构单元,则磷化硼的化学式为 ,微粒间存在的作用力为 。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如下图)。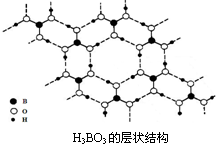
①硼酸分子中B最外层有 个电子,1 mol H3BO3的晶体中有 mol氢键。
②硼酸溶于水应生成弱电解质一水合硼酸H2OB(OH)3,它电离生成少量[B(OH)4]-和的H+离子。则硼酸为 元酸, [B(OH)4]-含有的化学键类型为 。
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2 的含量及有效地开发利用CO2 ,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,
在体积为1 L的密闭容器中,充入1mol CO2 和3mol H2 ,一定条件下发生反应:
CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2 和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 v (H2 )=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使 n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2 和3molH2 |
(2)①在载人航天器的生态系统中,不仅要求分离去除CO2 ,还要求提供充足的O2 。某种电化学装置可实现如下转化:2CO2 =2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH— —4e— =O2↑+2H2O
则阴极反应式为:____________________________。
②有人提出,可以设计反应2CO=2C+O2 (△ H >0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:_________;____________________________________。
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是 (正极或负极)。
(2)甲装置中电解反应的总化学方程式是 。
(3)如果收集乙装置中产生的气体,两种气体的体积比是 。
(4)欲用丙装置给铜镀银,G应该是 (填“铜”或“银”),电镀液的主要成分是 (填化学式)。
(5)装置丁中的现象是_____________________
硫及其化合物在国民生产中占有重要的地位。
(1)常温常压下,已知1g 硫完全燃烧放出a kJ的热量,写出硫燃烧热的热化学方程式
。
(2)又已知2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-bkJ/mol,写出H2S完全燃烧生成二氧化硫和水的热化学方程式 。
向盛有10滴0.1mol/L AgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成,再向其中滴加0.1mol/L KI溶液,观察到 ;然后向其中滴加0.1mol/L Na2S溶液,又观察到 。
净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层.外层的优氯净 Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去.
(1)优氯净中氯元素的化合价为 .
(2)亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 .
(3)亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 .