氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。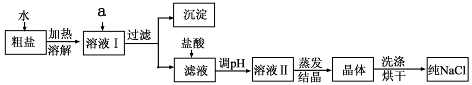
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、 、 ;
②在滤液中加盐酸的作用是 ;
(2)用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有玻璃棒、 和 ,其中玻璃棒在该实验中所起的作用是_____ ___。
②如果配制后溶液溶质的质量分数低于0.9%,你认为可能的原因是 。(任写一个)
化学小组用如图所示实验探究铁生锈的条件,其中A、B为敞口试管,C盖有严密的橡胶塞.A和B下层都装有煮沸过的蒸馏水,B的上层有植物油,C内是干燥的空气.(每支试管中均放有相同的铁钉)
(1)实验前将蒸馏水煮沸的目的是 .
(2)通过对比 (填序号,下同)两个试管的现象说明铁生锈必需有氧气参加,通过对比 两个试管中现象.说明铁生锈必须有水参加.从而得出结论:铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果.
(3)某同学想探究一下铁钉在生锈过程中,蒸馏水中溶有NaCl,对生锈的影响,你帮他设计实验,写出实验方案.
(4)为了保护金属资源,除了防止金属被锈蚀外,写出一条措施 .
某化学兴趣小组对一包干燥的白色粉末组成进行探究.请你参与并回答有关问题:
【教师提醒】它由碳酸钙、碳酸钠、氢氧化钠三种固体中的一种或两种组成.
【提出猜想】白色粉末可能的组成有:①只有碳酸钙;②只有碳酸钠;③只有氢氧化钠;④是碳酸钠、碳酸钙的混合物;⑤是碳酸钙、氢氧化钠的混合物;⑥是碳酸钠和氢氧化钠的混合物.
【探究思路】利用物质的性质不同设计实验加以甄别,先分别探究其中是否含有碳酸钙,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究其组成.
【查阅资料】
1、碳酸钠俗称纯碱,溶液呈碱性. 2.CaCl2、Ca(NO3)2、BaCl2等溶液呈中性.
【实验探究】
(1)甲同学取适量白色粉末装入试管中,然后加入足量的水,振荡.结果白色粉末全部溶解,从而排除猜想中的 (填猜想中的序号).
(2)在甲同学实验结论的基础上,乙同学另取少量白色粉末于试管中,加入足量的水溶解后再滴加2~3滴酚酞试液,振荡后观察,溶液变成红色.乙同学认为只有猜想③正确,可是丙同学却不是这样认为,他的理由是 .
(3)丁同学进一步确定白色粉末的组成,在甲同学所得的溶液中加入足量的稀盐酸,结果有气泡产生,于是丁同学认为可以排除猜想③,试写出产生气体的反应的化学方程式: .
【交流讨论】
通过上述实验探究,小组内展开了激烈的讨论,有的同学认为猜想②正确,有的同学认为猜想⑥正确,各执一词.于是小明同学想出一种方法:在甲同学所得的溶液中先加入过量的 溶液,然后再滴入 ,根据看到的 的现象,从而得出猜想⑥是正确的.
【反思评价】
戊同学指出:实验是学习化学的重要的手段,但要注意实验的严谨性,如果小明同学加入的试剂的先后顺序颠倒一下,你认为 (填“能”或“不能”)准确验证猜想⑥正确.
暖宝宝是一种防寒用品,如图所示,暖宝宝中的主要成分有哪些?发热的原因是什么?
(1)小明探究:暖宝宝中的主要成分是什么?剪开内包装袋,倒出其中的粉末,发现呈黑色.
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化三铁中一种或几种.
【初步验证】将磁铁靠近黑色粉末,部分被吸引.
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引.
【得出结论】该黑色粉末可能含有 .
【进行实验】
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取黑色粉末加足量稀硫酸 |
固体部分溶解,有气泡产生,溶液无蓝色 |
| ② |
取实验①的残渣灼烧,将内壁涂有澄清石灰水的小烧杯罩在上方 |
澄清石灰水变浑浊 |
由实验①可知,该黑色粉末肯定含 ,肯定不含 .写出实验①的化学反应方程式 .
由实验②可知,该黑色粉末肯定含 .
(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量.由此可见,人们可以利用化学反应放出的能量,请再举一例: .
某兴趣小组的同学在老师的指导下,对一瓶没有塞橡皮塞的氢氧化钙溶液进行探究,请你一起参与.
【提出问题】该氢氧化钙溶液是否全部变质?
【猜想与假设】猜想①:氢氧化钙溶液可能全部变质,变成碳酸钙.
猜想②:氢氧化钙溶液可能部分变质,其成分是 .
【实验探究】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取样于试管中,滴加稀盐酸 |
有 生成 |
原溶液里一定有碳酸钙 |
| (2)另取样于试管中,滴加酚酞试液 |
溶液成红色 |
原溶液一定有 |
【实验结论】综合上述实验(1)、(2),你得出的结论是猜想 成立.
【反思拓展】(1)氢氧化钙露置于空气中容易变质,原因是 (用化学方程式表示).
(2)在分析化学反应的物质成分时,除了考虑生成物外,还需考虑的是 .
测定溶解度有多种方法,下列是测定30℃时硫酸铜溶解度的实验方法。经查找资料,30℃时硫酸铜的溶解度为25g/100gH2O。
一、配置30℃时的硫酸铜饱和溶液:
(1)配置的步骤如图:
取用100mL水,图中称量得到22.2g硫酸铜用于实验,是否合理,请说出理由;并在30℃的水浴中加热硫酸铜溶液一段时间,保证硫酸铜完全溶解,得到饱和溶液。
二、测量一定质量饱和硫酸铜溶液中硫酸铜的质量:
(2)在已配得的30℃时饱和溶液中,迅速取出饱和溶液50g,采用蒸发的方法求得硫酸铜的质量。从饱和溶液中析出蓝色晶体的化学式为(10),得到晶体后还要继续加热,直至固体颜色变为(11)色为止。此操作过程中,用到的仪器除铁架台、酒精灯外,还需(12)。
(3)最后称量得到固体质量为9.8g,经计算得到此时硫酸铜的溶解度为(13)g/100gH2O(精确到0.1g)。实验反思:实验数值比资料中的数据偏小,可能的原因是(14)(写出一条即可);
(4)测量50g饱和硫酸铜溶液中硫酸铜的质量,还可以使用重量法。
实验原理:CuSO4+BaCl2 →CuCl2+BaSO4↓
该实验方法中一定还要用到的实验操作是(15)(填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)