体积不变的密闭容器中进行如下反应: X2(g) + 3Y2(g)  2Z(g),X2、Y2、Z起始浓度分别为 0.2mol?L—1 、 0.6mol?L—1、0.4mol?L—1,当平衡时,下列数据肯定不对的是
2Z(g),X2、Y2、Z起始浓度分别为 0.2mol?L—1 、 0.6mol?L—1、0.4mol?L—1,当平衡时,下列数据肯定不对的是
| A.X2为0.4mol?L—1,Y2为1.2mol?L—1 | B.Y2为1.0mol?L—1 |
| C.X2为0.3mol?L—1,Z为0.2mol?L—1 | D.Z为0.6mol?L—1 |
某芳香化合物的分子式为C8H8Cl2O2,其分子结构中有三种不同化学环境的氢,它们的数目之比为6︰1︰1,且分子中的Cl原子皆形成C-Cl键,则其可能的结构有(不考虑O与O相连接)
| A.2种 | B.3种 | C.4种 | D.5种 |
下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是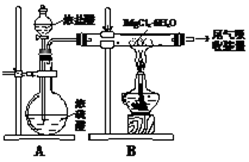
| A.装置A中圆底烧瓶中可以换成固体MnO2 |
| B.如果直接加热MgCl2•6H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO |
| C.尾气吸收可以用浓硫酸作为吸收剂进行吸收 |
| D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火 |
LiAlH4( )、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
| A.LiH与D2O反应,所得氢气的摩尔质量为4 g/mol |
| B.1 mol LiAlH4在125℃完全分解,转移3 mol电子 |
C.LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4 + 2H2O LiAlO2 + 4H2↑ LiAlO2 + 4H2↑ |
| D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
甲、乙、丙、丁4种化合物均含有2种或3种元素,分子中均含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙和甲中同种元素的质量分数相等,则乙中含有化合价为-1的元素 |
| C.丙与氧气的摩尔质量相同,则丙一定仅由两种元素组成 |
| D.丁中含有第二周期ⅣA族元素,则丁一定是甲烷的同系物 |
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是
| A.酸性由强至弱:HX>HY>H2CO3 |
| B.结合H+的能力:Y->CO32->X->HCO3- |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |