用0.2mol/L HCl溶液滴定0.2mol/L NaOH,如果到达滴定的终点时不慎多加了1滴盐酸溶液(1滴溶液的体积约为0.05mL),继续加水至100mL,所得溶液的pH是
| A.4 | B.1 | C.10 | D.3.3 |
下列说法正确的是
| A.化学反应中的能量变化都表现为热量变化 | |
B.凡是需要加热后才能发生的反应是吸热反应 |
C.在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热 |
| D.物质发生化学反应都伴随着能量变化 |
下列叙述中正确的是
| A.含有离子键的化合物一定是离子化合物 |
| B.具有共价键的化合物一定是共价化合物 |
| C.在化合物CaCl2中,两个氯离子之间也存在离子键 |
| D.化学键是分子中多个原子之间强烈的相互吸引作用 |
元素性质呈现周期性变化的基本原因是
| A.元素的原子量逐渐增大 | B.核外电子排布呈周期性变化 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |
现行元素周期表中已列出112种元素,其中元素种类最多的周期是
| A.第4周期 | B.第5周期 | C.第6周期 | D.第7周期 |
在一定温度下,4L密闭容器内存在反应 ,其中气体M、气体N的物质的量随时间变化的曲线如图所示:
,其中气体M、气体N的物质的量随时间变化的曲线如图所示: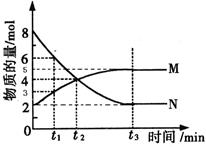
(1)比较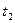 时刻,正逆反应速率大小V正V逆。
时刻,正逆反应速率大小V正V逆。
(2)若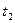 =2min,计算反应开始至
=2min,计算反应开始至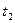 时刻,M的平均化学反应速率为:_____________________________。
时刻,M的平均化学反应速率为:_____________________________。
(3)t1与t2相比,反应速率__________较慢,其原因是__________________;已知该反应是放热反应,则N的能量___________M的能量(填“大于”、“小于”、“等于”)镁条和盐酸的总能量。