氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。合成氨反应:N2(g)+3H2(g) 2NH3(g)△H
2NH3(g)△H
(1)若该反应在一定条件下能自发,则该反应的△H 0、△S 0(填“<”、“>”或“=”)。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是 。
| A.3v(H2)正=2v(NH3)逆 |
| B.单位时间内生成n mol N2的同时生成2n molNH3 |
| C.混合气体的密度不再改变 |
| D.容器内压强不随时间的变化而变化 |
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表的①②处填入合适的实验条件数据。
| 实验编号 |
T(℃) |
n (N2)/n(H2) |
P(MPa) |
平衡时NH3百分含量 |
| ⅰ |
450 |
1/3 |
1 |
|
| ⅱ |
① |
1/3 |
② |
|
| ⅲ |
480 |
1/3 |
10 |
|
从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。
试回答下列问题:
(1)写出用海滩上的贝克制取Ca(OH)2的化学方程式:
。
(2)写出电解熔融氯化 镁制取镁的化学方程式
镁制取镁的化学方程式 :。
:。
(3)将电解生成的氯气通入氢氧化钠溶液中可得到一种消毒液,写出反应的化学方程式: 。
。
(4)粗盐中常含有Ca2+、Mg2+等杂质,可用Na2CO3、NaOH除去。精制过程发生反应的离子方程式为、。
(5)为有效除去Ca 2+、
2+、 Mg
Mg 2+、SO
2+、SO ,加入试剂的合理顺序为
,加入试剂的合理顺序为 (选填a,b,c)
(选填a,b,c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂 ,再加Na2CO3
,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
有机物X是有机合成工业中一种重要的中间体。X可以由有机物A经过一系列反应制得,也可由另一种有机物Y在一定条件下制得。合成路径如下图所示: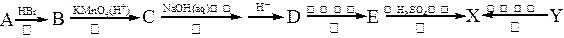 已知:①
已知:①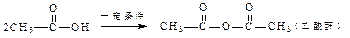
②Y分子中C、H、O(不含其它元素)的个数比为1:1:1,且Y的相对分子质量的范围在80-160之间。
③Y是一种二元酸,且能使Br2/CCl4褪色。
④E和X中都含有五元环。
请回答以下问题:
(1)请指出反应类型:反应②______________,反应⑤_____________。
(2)Y的分子式为_______________;X的结构简式为_______________。
(3)反应①和②的顺序不能调换,请简述理由_________________________________ _。
_。
(4)化合物D在浓H2SO4催化作用下能生成一种高分子化合物,请写出该反应方程式
______________________________________________________。
(5)化合物D有许多同分异构体,其中同分异构体D1和D2都满足以下条件:分子中含有酯基结构,且D1和D2都是二元酸。请写出D1、D2的结构简式:_____________,
_____________。
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢 氧化物形式沉淀时溶液的pH见下表:
氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为。
(2)加入碳酸钠调节pH至a,a的范围是;pH调至a后过滤,再用试剂X将滤液的pH调节至2-3,则所用的试剂X为___________。
(3)操作Ⅰ包含3个基本实验操作,它们是、和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是(写出两个原因)。
(6)在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是。
Ⅰ.氮是地球上含量丰富的一种元 素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
素,氮及其化合物在工农业生产、生活中有着重要作用。请回答: (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g)2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g)2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K/(mol·L-1)2 |
4.1×106 |
K1 |
K2 |
… |
完成 下列问题:
下列问题:
①比较K1、K2的大小:K1K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是(填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式。
②盐酸肼水溶液中离子浓 度的排列顺序正确的是(填序号)。
度的排列顺序正确的是(填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
 |
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为: 。
。
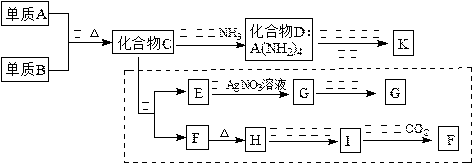
材料科学是近年来与化学有关的科学研究热点。某新型无机非金属材料K由两种非金属元素组成。它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。它是以中学化学中常见物质为原料来生产的。下图虚线框内的其它转化是为探究C的组成而设。G、F、H均为难溶于水的白色固体;图中C、H、K均为含A元素。其余物质均为中学化学中常见物质。
 |
请回答下列问题:
(1)指出K可能所属的晶体类型,K中含有的化学键类型为。
(2)写出化学式:化合物C;化合物F。
(3)写出反应③的化学方程式:。
(4)写出反应⑤的离子方程式:。
(5)化合物K与化合物C类似,也能在一定条件下与水反应生成两种化合物,请写出K与水反应的化学方程式:。